 市场资讯
市场资讯新闻资讯 更多+
儿童药是指14岁以下未成年人使用的专用药品,包括专门针对儿童的专用药品或药品说明书中标明儿童使用用法用量的药品。总体而言,目前我国儿童用药市场不成熟,儿童用药配备不足,呈现“三少两多”的市场特点,一是儿童专用药品种少、剂型少、剂量规格少、普药多、不良反应情况多。二是儿童药药品口感不好,用药依从性差,长期存在“用药靠掰,剂量靠猜”,“小儿酌减”情况,儿童滥用药物严重危害儿童健康。随着国家更加关注儿童成长,社会和家庭规范用药意识增强,儿童药市场规模将逐步提高。
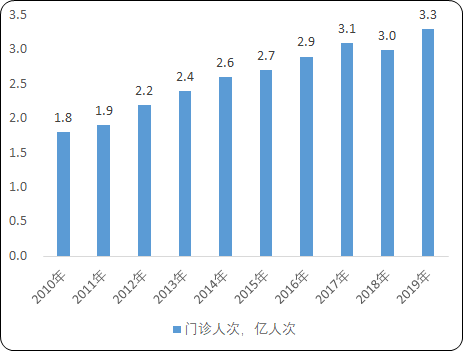
(1)儿童药市场潜力大:据国家统计局在2020年1月发布了中国截止2019年年底的人口数据,我国0~15岁周岁人口占总人口比重为17.9%,数量达到2.5亿人。根据国家卫生健康委员会《中国卫生健康统计年鉴》数据统计,医疗卫生机构儿科门诊率稳步上升,2019年医院儿科门急诊就诊人数达到3.3亿人次,一定程度上带动了儿童药市场容量的上升。
2010-2019年中国儿童门诊人次分析
数据统计:中金企信国际咨询
目前国内儿童药种类少,剂型缺,用药规范待提升。国内现有的3500多个药品制剂品种中,儿童专用药品种仅有60多种,比例仅占1.7%,儿童专用药品种极其短缺。儿童常用处方药中,注射剂和片剂居多,儿童用药的依从性和便利性不足,口服溶液、滴剂、口服混悬剂、掩味颗粒剂等适宜儿童服用的剂型少。且儿童用药不规范使用现象多见,大部分说明书中未精准标示儿童用法用量,仅标识“儿童酌减”,为儿童用药安全带来很大障碍。随着国家对于儿童精准给药、安全用药的重视,儿童专用药空间发展巨大。
中金企信国际咨询公布《2021-2027年中国儿童用药行业市场发展态势及投资前景可行性报告》
2)政策扶持力度逐年加大:虽然我国儿童药政策建立健全与国外存在差距,但近年我国政府持续推出利好政策保障儿童药市场健康发展。2011年,国务院发布《中国儿童发展纲要(2011-2020年)》,为加强儿童疾病防治,鼓励儿童专用药品研发和生产,扩大国家基本药物目录中儿科用药品种和剂型范围,完善儿童用药目录。2014年,国家卫生计生委、国家发展改革委等六部委发布《关于保障儿童用药的若干意见》,从鼓励研发创制、加快申报审评、确保生产供应、强化质量监管、推动合理用药、完善体系建设、提升综合能力等环节,对保障儿童用药提出了具体要求。
同时,政策积极鼓励和支持儿童药的研发发展。CDE出台指导原则将大幅缩短儿童药研发周期,提速研发审批过程,促使该领域专业人才不断涌现,加速国内儿童专业药研发创新。
2020年鼓励儿童药研发主要政策(部分)分析
|
时间 |
部门 |
文件名 |
与儿童药发展相关的内容 |
|
2020年 |
国家市场监督管理总局 |
《药品注册管理办法》 |
符合儿童生理特征的儿童用药品新品种、剂型和规格,药品上市许可申请时,具有明显临床价值的药品,可以申请适用优先审评审批程序。 |
|
2020年 |
国家药品监督管理局 |
《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》 |
本指导原则着重介绍现阶段真实世界研究支持我国儿童药物研发时的常见情形及关注点,有关真实世界研究的基础概念、基本原则、研究设计及统计方法学等内容,指导原则适用于各类别儿童用药,包括化学药品、中药及生物制品。 |
|
2020年 |
国家药品监督管理局 |
《药品上市许可优先审评审批工作程序(试行)》 |
符合儿童生理特征的儿童用药品新品种、剂型和规格,可以申请适用优先审评审批程序。(1)对于新品种,应当满足以下任一条件:①针对严重威胁儿童生命或者影响儿童生长发育,且目前无有效治疗药物或治疗手段的疾病;②相比现有上市药品,具有明显治疗优势;(2)对于新剂型,应当同时满足以下两个条件:①现有上市剂型的药品说明书中包含有明确的儿童适应症和儿童用法用量信息;②现有上市剂型均不适用于儿童人群,新剂型属于儿童人群适宜剂型;(3)对于新规格,应当同时满足以下两个条件:①现有上市规格的药品说明书中包含有明确的儿童适应症和儿童用法用量信息;②现有上市规格均不适用于儿童人群,新规格适于儿童人群使用。 |
|
2020年 |
国家药品监督管理局药品审评中心 |
《化学仿制药透皮贴剂药学研究技术指导原则》 |
对开发儿童专用剂型具有重要的技术指导意义。 |
|
2020年 |
国家药品监督管理局药品审评中心 |
《化学药品改良型新药临床试验技术指导原则》 |
阐述化学药品改良型新药(以下简称化药改良新药)的临床优势以及不同优势化药改良新药的临床试验设计与评价原则,为化药改良新药临床研究提供技术指导和参考。 |
|
2020年 |
国家药品监督管理局药品审评中心 |
《儿童用药(化学药品)药学开发指导原则(试
行)》 |
为了进一步促进我国儿童药物研发,满足儿童用药需求,为儿童用药开发提供研发思路和技术指导,药审中心组织制定了儿童用药(化学药品)药学开发指导原则。 |
|
2020年 |
国家药品监督管理局药品审评中心 |
《儿科用药临床药理学研究技术指导原则》 |
为了促进儿童药品研发,进一步明确儿科用药临床药理学技术要求,药审中心组织制定了儿科用药临床药理学研究技术指导原则。 |
总体来看,在国家大力扶持儿童药发展背景下,随着广大人民生活水平日益提高,行业具有巨大的发展空间和良好的发展前景,处于大有可为的战略机遇期。
(4)儿童用药产业发展前景分析:近年虽然我国出生率呈下降趋势,但国内儿童人口基数依然巨大。同时,国内儿童用药市场尚不成熟,优质品种少、研发转化难、依从度差、循证研究缺失的情况突出,儿童专用药所占年药品注册批件比例极低,儿童用药市场规模远未饱和,专业儿童药产品市场成长空间巨大。根据国家卫生健康委员会《中国卫生健康统计年鉴》数据统计,医疗卫生机构儿科门诊率稳步上升,2019年儿科门急诊就诊人数达到3.3亿人次,一定程度上带动了儿童药市场容量的上升。据国家统计局2020年1月公布数据显示,截止2019年年底,我国0~15岁周岁人口占总人口比重为17.9%,数量达到2.5亿人,儿童群体基数庞大。2021年2月,中国国家卫健委表示东北地区可探索全面放开人口生育限制,未来如果进行全国性推行,第四次婴儿潮或将到来。
2021年是“十四五”开局、开启全面建设社会主义现代化国家新征程的一年。国家相关部门出台的多项政策对医药细分行业发展产生重要影响。
儿童用药方面,CDE出台指导原则将大大缩短儿童药研发周期,提速研发审批过程,促使该领域专业人才不断涌现,加速国内儿童专业药研发创新。2020年9月1日,CDE发布《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》通告,真实世界研究作为新研究方法中的一种,逐步用于支持儿童药物的研发与审评,为新药注册、扩展儿童适应症、完善儿童剂量方案等提供支持。药理机制明确,具备可靠的境外儿童临床研究证据和国内儿科临床应用基础,用于儿科人群的临床疗效明确,经过获益风险评估,可实施中国儿童临床研究豁免。
罕见病方面,国家重视罕见病群体,鼓励罕见病药物研发生产。随着国家经济社会发展和人民生活水平的提高,罕见病受到社会各界关注,国家卫健委已经着手加大罕见病防治力度。2020年1月,国家卫健委办公厅关于设立全国罕见病诊疗协作网办公室的通知;2020年9月2日,国家卫健委关于印发国家卫生健康第二届罕见病诊疗与保障专家委员名单的通知,鼓励罕见病治疗药品研发。
2021年,国内医改大环境进入新的阶段,国家基药目录扩容、新医保目录挂网招标、药品带量采购及动态调整,按病种付费(DRGs)扩大试点等一系列举措的落实,国内医药企业将迎接新一轮的机遇和挑战。2021年国家基药目录即将调整,国家基药政策将使得基本药物的价值凸显,基药配备的大幅提升将挤占其他药品的临床使用。根据国务院办公厅发布《关于完善国家基本药物制度的意见》,对通过一致性评价的药品品种,按程序优先纳入基本药物目录。未通过一致性评价的基本药物品种,逐步调出目录。鼓励医疗机构优先采购和使用通过一致性评价、价格适宜的基本药物。2020国家医保目录于2021年3月1日起正式执行,连同各省市地方增补药品目录将直接挂网采购。目前全国多地鼓励医疗机构采购和使用通过一致性评价的产品,同品种达到3家及以上通过一致性评价的,在招投标中将不选用未通过的产品。

 400-1050-986
400-1050-986

