 研究报告
研究报告新闻资讯 更多+

【咨询热线】010-63858100/400-1050-986
【24小时咨询】13701248356
【交付方式】EMS/E-MAIL
【报告格式】WORD 版+PDF 格式 精美装订印刷版
【订购电邮】zqxgj2009@163.com
【企业网址】www.gtdcbgw.com , www.bjzjqx.com , www.chinabgw.net
专精特新-生物制品外源风险因子检测试剂盒行业市场占有率报告(2024)
全球及中国生物制品外源风险因子检测试剂盒市场全景监测调研及竞争战略可行性预测报告(2024版)
(1)生物制品外源风险因子检测试剂盒介绍及应用场景分析:外源风险因子是指在生物制品生产过程可能引入的污染物,包括细菌、真菌、支原体和内外源性病毒等。外源因子引入生物制品,不仅会导致产品品质下降,还会降低表达水平并最终导致产量降低,甚至可能会使使用者发生感染,因此应采用适宜且可靠的方法对其进行定性或定量分析,以确保外源风险因子可控。
使用传统方法进行外源因子检测具有较大的局限性,如采用培养法进行细菌、真菌及支原体检测,其检测时间较长,对于细胞治疗类产品,其检测周期甚至长于产品生命周期;此外,检测灵敏度高的方法一般需要相对高昂的检测费用,这会增加企业的研发及生产成本。
随着技术的发展,外源风险因子检测试剂盒应运而生,其可用于所有生物制品中外源因子的定性检测,使用范围贯穿生物制品的生产起始阶段、生产中间阶段及终产品阶段。外源风险因子检测试剂盒在使用极少样本的同时,检测灵敏度依然能够达到药典的要求。此外,外源风险因子检测试剂盒能够将微生物如真菌、细菌及支原体的检测时间由几天至十几天缩短至几小时,大幅缩短检测时间,帮助企业提高检测效率。
(2)生物制品外源风险因子检测必要性分析:外源因子指无意间引入于接种物、细胞基质和/或生物制品中所用的原材料及产品中的可复制或增殖的污染物,包括细菌、真菌、支原体、病毒等。外源因子风险控制与生物制品质量和安全性密切相关,细胞基质及细胞培养过程中引入的各类外源因子,会增加患者的感染风险与副反应发生概率。各国政府越发重视外源因子的质控,相继出台《生物技术产品的病毒安全性评价》《动物细胞作为生物制品生产基质的建议及细胞库的鉴定》《疫苗生产用细胞基质的技术审评一般原则》《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》等外源因子安全性质量控制相关指导原则,以规范外源因子的安全性风险评估与质控环节。
由于抗体类、重组蛋白质类、细胞基因治疗类等不同生物制品的生产工艺存在一定差异,其外源因子风险控制侧重点也有所不同。相较于传统重组蛋白质类或抗体类生物制品,细胞治疗类、基因治疗类、组织工程类等新兴治疗产品由于新颖、多样且特殊,当前尚无成熟、统一的针对新兴治疗产品外源因子控制和评价的指导原则。
此外,部分新兴治疗产品在工艺步骤中缺乏除菌过滤和/或病毒灭活等去除工艺步骤,其于生产工艺环节中的外源因子风险控制更为重要,需自原材料及辅料选择阶段起加强对外源因子的控制。在检定中,除关注细菌、真菌、支原体、分枝杆菌、噬菌体、内/外源病毒因子、逆转录病毒等常规检测项外,还应重点关注人源性病毒、鼠源性病毒等种属特异性病毒、培养过程中引入的牛血清相关牛源性病毒等潜在病毒、细胞改造用病毒载体相关病毒等历史溯源提示的潜在外源因子、病毒载体历史包装细胞相关的潜在病毒等。外源因子的控制与评价在生物制品的全生命周期中始终占有较大比重,在研发早期,尤其是IND阶段,由于生物制品自身理化特性与生物学活性仍处于不断完善和补充的阶段,外源因子的控制极大程度上影响了产品的安全性。不同生物制品外源因子质量标准项目的设定需结合产品自身特点与生产工艺具体考虑,外源因子的控制于IND评价中极为重要。
(3)快检技术在外源风险因子检测中的应用及优势与必要性分析:近年来,基因编辑技术、免疫学、病毒载体等多学科领域的快速发展,科学研究成果不断转化应用,新兴生物制品逐年增多。随着免疫细胞治疗、干细胞治疗、基因治疗、溶瘤病毒等新兴生物制品的涌现,政府监管部门就外源风险因子检测提出了更具有针对性的质控要求与检测方法建议。
外源因子检测方法需基于外源因子、不同细胞基质的来源与历史来确定,外源因子检测方法的专属性、精密度、灵敏度、检测限、耐用性等方面需满足产品的检测需求。无菌、支原体等药典方法检测时限相对较长,对于部分有效期较短的生物制品,如细胞治疗产品,药典方法可能无法满足产品放行检测。
2020年版《中国药典》中的传统无菌检查方法存在检测时间长、效率低、部分微生物在指定试验条件下不易生长、样品量少可致使无菌检查试验检测污染物能力受限等局限性。2021年10月,国家药典委员会发布《关于细胞类制品微生物检查法通则草案的公示》;2022年12月,国家药典委员会发布《关于细胞类制品微生物检查指导原则标准草案的公示(第二次)》,就细胞类制品领域明确无菌检查替代方法的必要性,并指出在风险评估的基础上有条件地采用快速微生物检查法以替代经典无菌检查法。与此同时,采用自建的无菌或支原体快速放行检测方法以替代药典方法用于产品放行检测时,应参考《药品微生物检验替代方法验证指导原则》对快速放行方法的可替代性进行验证,在充分验证方法可替代性之前,应在采用快速放行方法进行产品放行的同时,同步留样进行药典方法的检测,以对检测结果进行进一步确认。而经验证过的微生物快检商业化试剂盒的应用可为下游生物制品生产厂商提供检测便利。
(4)生物制品外源风险因子检测主要分析方法介绍:目前,外源因子的检测方法主要分非特异性和特异性的方法,非特异性方法主要包括琼脂培养法及细胞培养法,其检测范围较为广泛,可以检测多种外源因子,但缺点是某些种类的微生物或病毒可能因宿主问题而检测不出,且检测过程耗时较长。特异性检测方法主要是针对具体外源因子的分子生物学检测方法,如针对基因序列的PCR技术,其优点是灵敏度高,缺点是对于未知序列的微生物无法通过设计引物来进行检测。目前,针对细菌/真菌/支原体可以通过培养法、PCR法等进行检测;对于病毒性外源因子的检测方法通常为体内试验(采用实验动物,如乳鼠,小鼠,鸡胚等进行培养)、体外试验(如细胞培养法等)、种属特异性病毒的检定(针对具体病毒属的基因序列特征采用实时PCR方法和基因测序技术)。
(5)生物制品外源风险因子检测试剂盒研发难点分析:生物制品生产的细胞代次、接种密度、敏感指示细胞的选择等因素都可能影响外源风险因子检测的灵敏度。此外,经典培养法检测微生物耗时长,部分微生物的体外培养具有很高的技术难度,难以复制扩增,存在漏检的风险。对于内外源病毒的检测,需将污染程度、细胞对病毒的敏感性及培养条件等因素纳入考量。指示细胞对外源病毒的敏感度将影响病毒的复制水平,进而影响污染物是否能够被检测出来。而如果外源病毒在指示细胞上复制,亦可能无法观察倒典型的细胞病变,进而出现假阴性等情况。故此,要准确地检测出生物制品中是否存在外源风险因子的污染,尤其是污染程度较低的外源风险因子,对试剂盒的灵敏度以及在不同复杂情况中的通用性都提出了挑战,要求厂商在试剂盒的研发过程中进行大量研究和验证工作,并根据客户的反馈情况进行相应调整,以适应生物制品的生产实际。
对于外源风险因子检测,传统的药典检测方法耗时较长,因而不适用于药物研发阶段的快速反馈、货架期短的生物制品以及市场需求量大的产品所需的快速批量放行检测。快检方法开发与专业试剂盒开发对试剂厂商的研发与生产能力提出了更大挑战,目前国外可提供相关商业化产品的厂家主要集中在赛默飞、赛多利斯、罗氏等几家跨国企业,国产上市产品主要是湖州申科生物技术股份有限公司自主开发,均需要解决产品特异性、灵敏度、覆盖率、适用性,以及生产工艺中的污染控制难题。
(6)中国生物制品外源风险因子检测试剂盒市场规模和预测:外源因子通常指生产活动中引入的细菌、真菌、支原体、分枝杆菌、内/外源病毒等污染微生物,鉴于外源因子对生物制品安全性的影响,国内外监管机构就外源因子发布了一系列外源因子控制理念相关指导原则。
当前,就外源因子检测而言,培养法等传统检测方法的检测时间较长,对于细胞治疗类产品,其检测周期甚至可长于产品生产周期。随着技术的发展,外源风险因子检测试剂盒应运而生,其可用于所有生物制品中外源因子的定性检测,使用范围贯穿生物制品各生产阶段,大幅缩短检测时间。此外,外源风险因子检测试剂盒可在使用极少样本的同时,实现可达药典要求的检测灵敏度。
另外,外源因子的检测需求大,其不仅局限于药品类生物制品领域,于III类植入器械、兽用生物制品、动物源性生物材料、宠物用品等多个领域皆存在检测需求,这将促使外源风险因子检测试剂盒的应用范围不断拓宽,推动市场进一步增长。
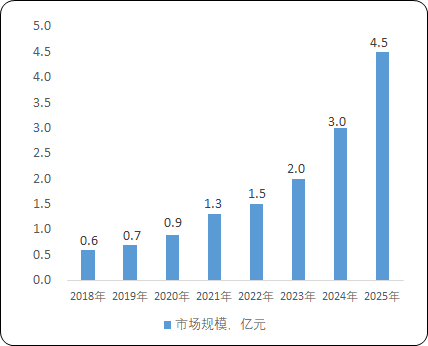
2022年,中国外源风险因子检测试剂盒市场规模达到1.5亿元,2018年至2022年的复合增长率为23.7%。为应对细胞与基因治疗(CGT)行业的产品特点,国内外厂商开发的微生物快检试剂盒上市时间随短,但具有替代经典培养法的潜力。随着生物药市场规模的快速增长及药企对外源因子检测试剂盒的优势认知加深,国产外源风险因子检测试剂盒市场规模将快速增长,将40.1%的复合年增长于2025年增至3.5亿元。
2018-2025年中国生物制品外源风险因子检测试剂盒市场规模现状及预测
数据整理:中金企信国际咨询
1)中金企信国际咨询(全称:中金企信(北京)国际信息咨询有限公司)为国家统计局涉外调查许可单位&AAA企业信用认证机构,致力于“为企业战略决策提供行业认证&证明、产品认证&证明、资信&信用调查评估、项目可行性&商业计划书专业解决方案”的专业咨询顾问机构。
2)截止2023年中金企信国际咨询已累计完成各类咨询项目15万余例(其中完成:专项调查项目数量25000+例。项目可行性&商业计划书42000+例。行业研究报告83000+例。),各类认证及证明&资信&信用调查评估项目约13500+例(其中:资信&信用调查评估项目3900+例,市场占有率&市场份额认证&证明项目3200+例,专精特新&小巨人认证&单项冠军证明项目2900+例,行业地位&品牌认证&服务项目2000+例,销售排名&领先认证&证明项目1500+例),为2.3万+不同领域企业提供专业、权威的三方认证服务。
3)资信&信用数据市场评估报告-中金企信国际咨询致力于为各领域企业&机构等提供合作风险规避、投融资信用依据、合作伙伴审核&审查等根据不同需求、不同使用目的出具专业、权威、严谨的资信&信用报告。2020-2022年中金企信国际咨询已累计完成各类资信&信用调查评估报告3900+例,涉及各类企业&机构3000+家含世界500强企业、中国百强企业、银行&券商、高校&科研院所、各级政府机构、各类投资公司、各领域企业。
4)专精特新“小巨人”&单项冠军市场占有率、市场排名认证服务-中金企信国际咨询。
5)项目可行性报告&商业计划书专业权威编制服务机构-中金企信国际咨询:集13年项目编制服务经验为各类项目立项、投融资、商业合作、贷款、批地、并购&合作、投资决策、产业规划、境外投资、战略规划、风险评估等提供项目可行性报告&商业计划书编制、设计、规划、咨询等一站式解决方案。助力项目实施落地、提升项目单位申报项目的通过效率。
1、企业填写“企业信息反馈表”确认订购意向;
2、由我方出示合同样本,双方确认合同条款即可签署达成合作;
3、双方按照合同条款约定订购方按合同约定金额汇入我方账户;
4、我方确认订购方款项到账后以邮件与快递形式将材料与国家认可正规发票提供订购方(注:相关细节合同条款中有具体体现)
购买了此报告的客户还购买了以下的报告 更多+
-
 2026-2032年数字医疗市场竞争力分析及投资...2026-2032年数字医疗市场竞争力分析及投资战略预测研发报告-中金企信发布2026-02-02
2026-2032年数字医疗市场竞争力分析及投资...2026-2032年数字医疗市场竞争力分析及投资战略预测研发报告-中金企信发布2026-02-02 -
 全球与中国神经刺激器市场发展趋势及竞争格局评估预...全球与中国神经刺激器市场发展趋势及竞争格局评估预测报告(2026版)-中金企信发布2026-01-29
全球与中国神经刺激器市场发展趋势及竞争格局评估预...全球与中国神经刺激器市场发展趋势及竞争格局评估预测报告(2026版)-中金企信发布2026-01-29 -
 2026-2032年轮椅市场发展格局分析及投资规...2026-2032年轮椅市场发展格局分析及投资规模可行性评估预测报告-中金企信发布2026-01-13
2026-2032年轮椅市场发展格局分析及投资规...2026-2032年轮椅市场发展格局分析及投资规模可行性评估预测报告-中金企信发布2026-01-13 -
 2026-2032年血透机行业全产业结构深度分析...2026-2032年血透机行业全产业结构深度分析及投资战略可行性评估预测报告-中金企信发布...2026-01-12
2026-2032年血透机行业全产业结构深度分析...2026-2032年血透机行业全产业结构深度分析及投资战略可行性评估预测报告-中金企信发布...2026-01-12 -
 2025-2031年中国医疗机器人行业市场竞争格...2025-2031年中国医疗机器人行业市场竞争格局及市场前景预测分析报告2025-04-14
2025-2031年中国医疗机器人行业市场竞争格...2025-2031年中国医疗机器人行业市场竞争格局及市场前景预测分析报告2025-04-14 -
 2025-2031年全球与中国虚拟医疗诊断行业全...2025-2031年全球与中国虚拟医疗诊断行业全景调研与投资战略洞察报告-中金企信发布 ...2025-04-11
2025-2031年全球与中国虚拟医疗诊断行业全...2025-2031年全球与中国虚拟医疗诊断行业全景调研与投资战略洞察报告-中金企信发布 ...2025-04-11

 400-1050-986
400-1050-986 1741283285
1741283285

