 研究报告
研究报告新闻资讯 更多+
(1)基本概述:下一代测序技术(Next-generation sequencing, NGS)即高通量测序技术(High-throughput sequencing, HTS),以高输出量和高解析度为主要特色,能一次并行对几十万到几百万条DNA分子进行序列读取,在提供丰富的遗传学信息的同时,还可大大降低测序费用、缩短测序时间的测序技术。
同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能, 所以又被称为深度测序(Deep sequencing)。从测序技术发展本身来讲,NGS测序技术无论从测序片断的读长、速度、质量还是测序的时间、费用来说都有突飞猛进的改善。
(2)产品优势(高成功率+检出率+分辨率+较低成本):
①NGS有极好的检测成功率:高通量染色体异常检测与传统染色体核型分析技术相比成功率高,且对染色体结构异常的诊断有较高的敏感性。
据中金企信国际咨询公布的《2020-2026年中国NGS市场专项调研及投资前景可行性预测报告》统计数据显示:染色体异常是早期流产的主要原因。传统的G带核型分析是检测染色体数目和结构异常的金标准。但该技术有20%左右的失败率,有时还会因培养过程中母体细胞相对胎儿细胞过度生长而导致假阴性。Array-CGH已被证实适用于早期流产组织染色体异常诊断。现在,NGS技术被证实同样可用于CVS样本的检测。该研究证实了NGS和Array-CGH对CVS样本有极好的检测效率。
②NGS有更高的检出率:NGS和Array-CGH相对于核型分析和FISH技术有更高的检出率。
③NGS有更高的分辨率:基于NGS技术开发的染色体异常检测,全面覆盖23 对染色体非整倍性异常以及0.1Mb以上的染色体缺失或重复突变,同时可以检测低至5%的嵌合体。适用于流产组织、外周血、羊水、脐带血等多种样本,可用于辅助产前诊断或者自然流产、不孕不育、儿童发育异常等原因的排查,可以提供精准的遗传学筛查手段。
一般认为G带核型分析的分辨率为5-10M,但如果是非典型条带,或者在消化、染色时不充分,会出现10M以上的缺失或者重复无法检出的情况。样本缺失和重复都大于10M,而核型分析却未检出,Array-CGH和NGS能够检出。两者可检出低至0.1M以上的缺失/重复,在该研究中检出5.3%微缺失、重复,比例远高于核型分析。Array-CGH和NGS可以有效检出微小片段的缺失与重复,为流产原因的找寻提供遗传学支持。
④NGS检测周期短,成本低:NGS相对于核型分析还具有检测周期短、样本要求简单、试验技术更易标准化、无需细胞培养、更能反映真实的嵌合比例、方便排除母体污染等优势。而NGS相对于Array-CGH具有成本优势,而且随着测序技术的发展,成本会进一步降低。
(3)NGS高通量测序仪器原理:
①将目标DNA剪切为小片段;
②单个小片段DNA分子结合到固相表面;
③单分子独立扩增;
④每次只复制一个碱基(A、C、T、G),并检测信号;
⑤高分辨率的成像系统。
NGS几种主流产品介绍:NGS作为第二代DNA测序技术,最显著的特征是高通量测序(NGS),一次能对几十万到几百万条DNA分子进行序列测序,使得对一个物种的转录组测序或基因组深度测序变得方便易行。
目前,国内外市场上主流NGS测序产品主要有:罗氏公司的454测序仪(包括GS 20、GS FLX、GS FLX Titanium、GS Junior、GS FLX+等),Illumina公司的MiSeq、Solexa基因组分析仪、ABI公司的SoLid测序仪、Complete Genomics公司的Black Bird测序仪、Life Technologies 公司的Ion Proton(如今被Thermo Fisher收购)系列测序仪、Pacific Biosciences公司的Ion Torrent系统、PacBio RS II系列分析仪、华大基因(BGI)BGISEQ系列测序仪。
(1)我国各类肿瘤病种发病率:伴随着中国人口老龄化加剧、生态环境遭受破坏、不健康生活方式及食品安全问题凸现,国内肿瘤发病率多年持续上升,已成为一个必须高度重视的公共卫生问题乃至社会问题。根据统计数据:2017年全国恶性肿瘤发病率为352.5/10万,死亡率为225.17/10万,其中:以胸部肿瘤(肺癌、食管癌)为主的疾病对全球人类的健康和生命威胁逐年增大。如肺癌在中国每年新发肺癌超过60万人,占全球的三分之一以上,成为中国以及全球第一“杀手”。
单位:1/10万
|
小城市 |
中等城市 |
大城市 |
|||
|
前十位 |
发病率 |
前十位 |
发病率 |
前十位 |
发病率 |
|
肺癌 |
51.92 |
肺癌 |
57.9 |
肺癌 |
65.2 |
|
胃癌 |
36.45 |
乳腺癌 |
39.56 |
乳腺癌 |
59.68 |
|
肝癌 |
30.06 |
胃癌 |
35.74 |
肠癌 |
39.57 |
|
乳腺癌 |
29.89 |
肝癌 |
28.72 |
胃癌 |
27.50 |
|
食管癌 |
26.76 |
食管癌 |
26.85 |
肝癌 |
24.98 |
|
肠癌 |
18.61 |
肠癌 |
25.55 |
甲状腺癌 |
19.35 |
|
宫颈癌 |
15.65 |
甲状腺癌 |
8.27 |
食管癌 |
10.52 |
|
脑癌 |
6.88 |
宫颈癌 |
15.19 |
胰腺癌 |
9.62 |
|
白血病 |
5.2 |
胰腺癌 |
7.32 |
淋巴瘤 |
9.04 |
|
甲状腺癌 |
4.94 |
脑癌 |
6.87 |
肾癌 |
8.93 |
城市死亡率前十癌症分析
单位:1/10万
|
小城市 |
中等城市 |
大城市 |
|||
|
前十位 |
死亡率 |
前十位 |
死亡率 |
前十位 |
死亡率 |
|
肺癌 |
40.71 |
肺癌 |
47.79 |
肺癌 |
54.19 |
|
胃癌 |
25.91 |
胃癌 |
26.13 |
肝癌 |
21.8 |
|
肝癌 |
25.83 |
肝癌 |
25.89 |
胃癌 |
19.33 |
|
食管癌 |
18.99 |
食管癌 |
20.84 |
肠癌 |
19.08 |
|
肠癌 |
9.04 |
肠癌 |
12.41 |
乳腺癌 |
12.78 |
|
乳腺癌 |
8.44 |
乳腺癌 |
9.59 |
胰腺癌 |
8.96 |
|
脑癌 |
4.31 |
胰腺癌 |
6.88 |
食管癌 |
8.56 |
|
胰腺癌 |
3.75 |
脑癌 |
4.46 |
淋巴瘤 |
4.71 |
|
白血病 |
3.58 |
白血病 |
4.08 |
白血病 |
4.60 |
|
淋巴瘤 |
2.45 |
淋巴瘤 |
3.37 |
胆囊癌 |
4.44 |
数据统计:中金企信国际咨询
|
排名 |
男性 |
女性 |
|
1 |
肺癌 |
乳腺癌 |
|
2 |
胃癌 |
肺癌 |
|
3 |
肝癌 |
肠癌 |
|
4 |
食管癌 |
胃癌 |
|
5 |
肠癌 |
甲状腺癌 |
|
6 |
前列腺癌 |
肝癌 |
|
7 |
膀胱癌 |
宫颈癌 |
|
8 |
胰腺癌 |
食管癌 |
|
9 |
淋巴癌 |
子宫癌 |
|
10 |
脑癌 |
脑癌 |
数据统计:中金企信国际咨询
根据国务院办公厅日前印发《中国防治慢性病中长期规划(2017-2025年)》内容,目前,中国总体癌症5年生存率为30.9%。40岁之后人群癌症发病率快速提升,80岁达到高峰;预期寿命85岁时,一个人患癌风险竟然达36%。特别是在肺癌、胃癌、前列腺癌、大肠癌、肝癌、食管癌、子宫颈癌等方面,老年人的患病几率正在不断增加。
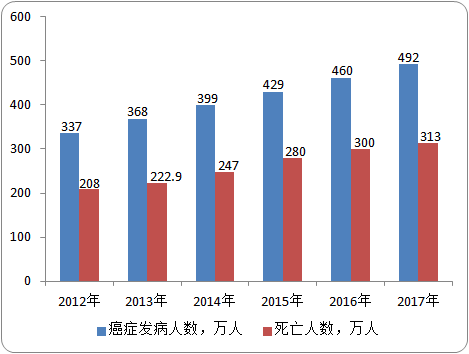
数据统计:中金企信国际咨询
根据统计数据:2017年中国新增肿瘤患者490万人,死亡人数313万人。专家表示:当前,中国新增癌症病例约490万,按照每例癌症基因检测花费1万元进行测算,肿瘤基因检测市场空间高达490亿元。如覆盖率达到35%,存在171亿元以上的市场收入。而目前肿瘤基因检测市场规模只有15-20亿元,未来发展空间巨大。
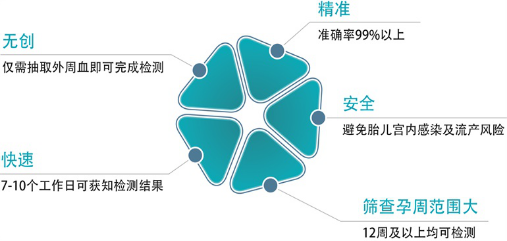
(1)基本概述:无创产前DNA检测(NIPT)是针对胎儿染色体数目异常疾病的新型检测技术,该方法采用新一代高通量测序技术结合生物信息学分析方法,对孕妇外周血中的游离DNA进行检测和分析,是一项安全、精确、快速的新型检测技术。
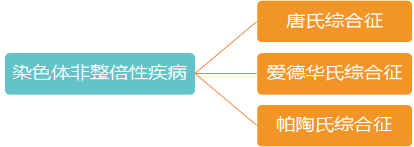
目前,无创产前检查不仅可以筛查唐氏综合症(21三体),还可以筛查爱德华氏综合症(18三体)、帕特氏综合症(13三体)以及提示其他非整倍体型遗传病。
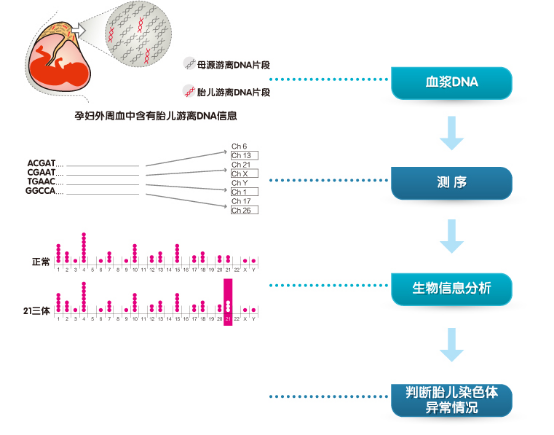
(2)技术原理:1997年,香港中文大学的研究人员发现孕妇外周血的血浆和血清中存在游离的胎儿DNA,这使得通过采集孕妇外周血检测胎儿的染色体疾病成为了可能。
近年来,高通量测序技术的发展十分迅速,相对于传统测序技术具有通量高、成本低的特点,每次实验可以产生几十Gb到几百Gb的数据量,同时单个核酸测序的成本则急剧下降。此外,高通过量测序技术的高准确性、高灵敏度等特点使得这项技术在人类健康领域得到广泛的应用。
(3)基本检测流程:
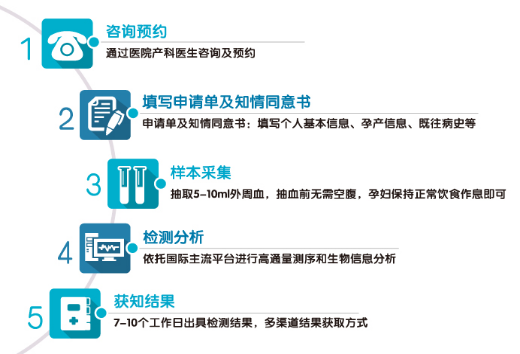
--检测准备:抽血前无需空腹,保持正常饮食作息即可;
--检测周期:抽血后10个工作日内出具专业检测报告;
--贴心保险:为了让每位孕妇更加放心地参加检测,国内一般检测机构会为所有受检孕妇购买保险。
(4)无创产前基因检测技术优势:无创产前DNA检测技术是国家专注健康、促进民生的重要项目之一,在国家相关政策法规的支持下,必将更好地辅助临床专家准确、高效地完成胎儿染色体非整倍性疾病的检测。
以唐氏综合征检测为例,研究发现,对于孕妇外周血中游离的胎儿DNA,由于唐氏综合征胎儿比正常胎儿多一条21号染色体,导致怀有唐氏综合征胎儿的孕妇外周血中21号染色体含量比正常孕妇略高。
通过对孕妇外周血中21号染色体的相对含量进行直接检测,分析比对受检者与普通孕妇人群的外周血中21号染色体含量水平,即可进一步得到受检者生育唐氏儿的风险。结合新一代高通量测序技术,其检测灵敏性和精确度大大提高,检测周期也大大缩短。
(5)市场规模:随着2016年无创产前检测试点取消,基于游离DNA的无创产前检测正式进入临床领域。根据市场调研资料:无创产检每例收费1800-3000元,中位数2400元。中国每年新增产妇数量2000万,35岁以上的高龄孕妇占25%有500万人,国家《母婴保健法实施办法》中明确规定强制进行产前检测;35岁以下产妇1500万。
|
35岁以上 |
人数,万人 |
500 |
||
|
市场规模,亿元 |
120 |
|||
|
35岁以下 |
假设渗透率 |
10% |
20% |
35% |
|
渗透人数,万人 |
150 |
300 |
525 |
|
|
市场规模,亿元 |
36 |
72 |
126 |
|
|
总市场规模,亿元 |
156 |
192 |
246 |
|
(6)我国试管婴儿累计数量(包括PGS/PGD):根据研究数据:40岁以上的妇女的成功受孕率还不到40岁以下妇女的一半。35岁的妇女流产率约为25%,40岁妇女流产率为33%,45岁妇女流产率上升到了50%。而且,用羊膜穿刺的方法检测年龄为35岁的产妇,其胎儿存在染色体异常的概率为1/132,40岁的为1/38,45岁的为1/12。如下图所示,试管婴儿20周后使用PGS(PGS是胚胎植入前遗传学筛查)比不使用PGS的受孕成功率高。胚胎遗传筛查的优势在于显著提升试管婴儿的胚胎移植成功率;降低自发性流产;提高怀孕率;确保单个胚胎的转运从而降低多胚胎的风险。
基因测序在辅助生殖中试管婴儿受孕成功率对比分析
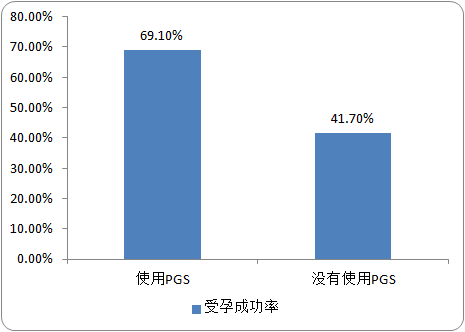
数据统计:中金企信国际咨询
统计数据显示:中国每年出生的婴儿数量在2300-2400万之间,按13.2%的不孕不育发病率计算,理论上每年应该还有303-317万的婴儿因为不孕不育无法生育。假设这部分婴儿的父母中的60%选择试管婴儿手术,则每年进行试管婴儿手术的夫妇为181-190万对。由于国内试管婴儿平均成功率不足30%,假设每对夫妇平均采用2.4次试管婴儿手术,按平均每周期PGS/PGD(移植前基因诊断)收费2500元计算,则潜在市场需求规模达110亿元以上。因此,未来中国辅助生殖基因测序市场需求前景较好。
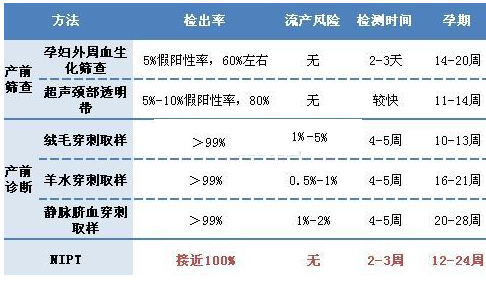
(1)无创产前检测(NIPT)为代表的生育健康领域:无创产前筛查和诊断是一种非侵入性产前检测,即通过采集孕妇外周血提取胎儿游离DNA的方式,精准检测胎儿染色体异常的状况,适用目标疾病21三体综合征、18三体综合征、13三体综合征等。相对于传统的检测技术(绒毛取样、羊膜腔穿刺等),具有精度高、风险低、无流产风险等优势。
随着高通量基因测序技术(NGS)的不断成熟,基于NGS技术平台的NIPT检测得到了大规模的推广和应用,根据国内进行的大规模的一期、二期临床试验结果显示:基于NGS技术平台的NIPT检测针对三大染色体非整倍体疾病的检测准确率高达99%以上,远高于血清学筛查,且假阳性率、假阴性率均更低。所以将三大染色体非整倍体疾病作为NIPT的目标疾病,有充分的、科学的临床数据支持。
(2)胚胎植入前遗传学病学诊断(PGS/PGD):胚胎种植前遗传学诊断(PGD)是指在体外受精过程中,对具有遗传风险患者的胚胎进行种植前活检和遗传学分析,以选择无遗传学疾病的胚胎植入宫腔,从而获得正常胎儿的诊断方法,可有效地防止有遗传疾病患儿的出生。
NGS技术在PGD和PGS中的应用:NGS是相对于传统的Sanger测序而言的。NGS改变了测序的规模化进程,其技术特征是不再区分单一模板,而是将模板变成了“库”,包括了需要测序的所有模板,同样是根据模板序列合成或者杂交形成互补链,通过互补链的延伸过程中引入的荧光标记来识别每个碱基。自2008年以来,全基因组测序费用呈指数级下降,这也是NGS能够进入PGD和PGS临床应用的一个重要条件。
NGS进行PGD和PGS也分为2种类型:一种是先将取材的细胞进行WGA,然后再进行NGS,这也是比较常见的方式。另一种是取材的胚胎细胞无需WGA,而是利用模仿PCR技术扩增大量的特异性片段,然后这些扩增的片段再进行NGS。
2013年的ESHRE年会上,Wells等汇报了NGS-PGS妊娠成功的病例;同年,华大基因与湘雅医院也报道了NGS检测囊胚的PGS成功病例。随后,多篇相关研究相继发表。NGS技术不仅在PGS中应用,通过测序深度的调整,NGS也在PGD领域内开始应用。2013年,Treff等对6例夫妇(囊性纤维化2例,Walker-Warburg综合征、家族性植物神经功能障碍症、X-连锁低磷性佝偻病、神经纤维瘤各1例)进行PGD诊断,遗传诊断技术分别采用其他实验室、qPCR和NGS技术分别来诊断。结果显示NGS的诊断结果与其他两种方法完全一致。2014年在北京大学第三医院生殖中心诞生了世界首例和第2例MALBAC扩增测序的PGD婴儿,分别诊断了遗传性多发性骨软骨瘤和X-连锁少汗型外胚叶发育不良。
NGS技术在PGD和PGS领域中的应用正在逐步发展,NGS技术最大的优点还在于它不仅可以检测胚胎的非整倍性,而且可以检测单基因疾病。这是其他技术尚不能达到的。
(3)染色体异常检测:染色体是组成细胞核的基本物质,是遗传物质基因的载体。在细胞复制过程中如果染色体不能正确分离或是出现断裂以及再次连接,就会导致染色体异常。染色体异常一般可以分为结构异常或数目异常。染色体数目或结构异常所致的疾病被称为染色体疾病。染色体疾病会影响机体的多个方面,其中最主要与自然流产、不育不孕、微缺失、微重复综合征等具有较高的相关性。
高通量测序染色体异常检测应用高通量测序(NGS)技术,并结合生物信息分析方法,对产前胎儿、自然流产、成人/儿童进行高通量测序染色体异常检测,全面排查产前胎儿异常、自然流产、儿童/成人表型异常、成人不孕不育的遗传因素可。本检测过程无需细胞培养,检出率与特异性均在99%以上。
专家表示:NGS染色体异常检测采用新一代测序技术,可以有效弥补核型技术的分辨率不高、部分情况细胞培养失败等缺点,同时还具有一系列的优点。采用高通量测序技术,可同时处理大量样本;不需要细胞培养,减少检测失败的比例;检测精度高,可发现染色体小片段改变,以及染色体微缺失微重复等异常;在染色体异常诊断方面可弥补核型分析精度不高的不足;同时可以发现未知的染色体异常突变。
(4)单基因病检测:单基因遗传病是指受一对等位基因控制的遗传病,有6600多种,并且每年在以10-50种的速度递增,单基因遗传病已经对人类健康构成了较大的威胁。较常见的有红绿色盲、血友病、白化病等。单基因病具有复杂的临床异质性及遗传异质性,基因突变涉及点突变、片段缺失或重复,甚至整个基因的缺失或重复,以及动态突变等多种类型,增加了该类疾病的诊断难度。
新兴的下一代测序NGS技术,实现了大规模平行测序,可对全基因组进行序列分析。为了便于检测数据分析,很多研究将某类单基因病所涉及的多个基因区域,制成特异性探针与基因组DNA在序列捕获芯片(或溶液)进行杂交,将目标区域DNA片段进行富集后再利用NGS进行测序,即目标序列捕获测序,可一次获得某类基因病涉及的所有相关基因的序列。在迅速锁定可疑致病突变的同时,可检测到大多数类型的突变,为单基因病的基因诊断带来了划时代的变化。
基于NGS技术的突变检测,有效突破了传统检测技术的效率瓶颈,但NGS通常获得大量的序列变异数据,鉴别变异是否为致病突变,不仅需要大量数据库的信息比对,更需要结合患者的临床表型、家系分析,才能获得正确的诊断结果。目前针对单基因病的NGS检测多数集中在第三方检验公司,对数据的准确分析、解读数据与疾病的关系,仍是目前NGS应用中的难点。
(5)耳聋基因检测:根据统计数据:中国我国现有听力语言残疾者达2780万人,其中单纯听力残疾2004万,占残疾人总数的24.16%,并以每年约2-3万人的速度增长,其中超过50%的耳聋由遗传基因缺陷所致。
伴随着基因组学技术的发展,耳聋分子遗传学研究逐渐成为耳科学研究的前沿领域。目前,对耳聋基因检的方法主要有线粒体DNAA1555G基因、GJB2基因、PDS基因、GJB3基因等。
目前,国内市场上利用NGS技术鉴定单基因遗传病的致病基因已逐步发展形成了一整套行之有效的研究方法体系,即第一步,收集家系样本;第二步,选择部分样本进行基因组扫描(全基因组重测序、全外显子组测序、疾病相关基因大规模平行测序、目标区域测序等);第三步,利用生物信息学分析筛选候选基因;第四步,在大规模病例和对照样本中验证突变;第五步,在分子、细胞、模式动物水平上进行基因功能验证及致病机制研究。
高通量测序技术的飞速发展使发现所有耳聋基因变成了可以实现的目标,大规模耳聋基因平行测序技术的开发和应用为临床耳聋基因诊断带来了革命性的发展机遇。大规模耳聋基因平行测序技术不仅在检测成本和检测周期上优于全基因组测序,数据分析也能根据比较完善的基因型与表型关联数据库迅速发现具有重要价值的信息。主要以编码序列为目标区域的大规模平行测序技术也存在一些不足之处:(1)不论哪一种捕获技术,在目标区域捕获时都存在偏倚,尽管增加测序深度可以一定程度弥补偏倚,但是仍有部分区域难以捕获;(2)大规模平行测序对基因组结构变异的检测具有局限性,通过增加测序深度和改进数据分析算法已经显著提高了CNV和indel的检测能力,但其灵敏度和特异度仍然低于点突变的检测;(3)大多数非编码序列和表观遗传学的修饰尚无法应用该技术检出,可能因此存在一定的假阴性结论,但是其变异对疾病的影响仍难以评价;(4)该技术获得的检测结果仍然需要通过基因分型、Sanger测序等方法进行验证,这些验证增加了检测耗时和成本,因此需要提高数据分析的效率;(5)在大量的检出数据中仍有SNV未确定是否与耳聋相关,即使在已知耳聋基因中,也有部分SNV的致病性尚存争议,不同人种的遗传背景差异也使得SNV致病性的判定需要更加大量的数据和详尽的分析。
由于耳聋基因研究和临床基因诊断所面临的巨大挑战,中国的科学家们在过去的几年中建立了一整套高效率低成本的耳聋基因变异自有检测技术,并联手成立了“中国遗传性耳聋基因研究战略联盟”,目前正致力于建立大规模的中国耳聋人群基因变异数据库,优化NGS数据分析策略,提高分析效率,将研究人员从海量NGS数据处理的沉重负担中解放出来,建立适用于中国人群耳聋基因大规模平行测序诊断流程,通过大样本的测序发现和弥补大规模平行测序的不足,为今后耳聋基因研究和临床基因诊断的发展和完善提供可靠的技术保证。
(6)病原微生物检测:近年来造成人类感染的病原微生物日益复杂,种类繁多,此外,抗菌药物滥用与细菌耐药已成为全球关注的焦点。在高通量测序 (NGS) 问世前,病原微生物基因组分析主要借助于桑格测序技术 (Sanger Sequencing), 实验周期较长,检测成本也较高。
随着科学的发展与技术的进步,NGS已经迅速成为临床实验室重要检测平台,延展提高了经典微生物方法的检测能力。对于微生物基因组序列的测定,除测序设备外,计算机以及各种分析算法/软件,以及参考数据库也必不可少,共同组成基因组测序“三大件”。
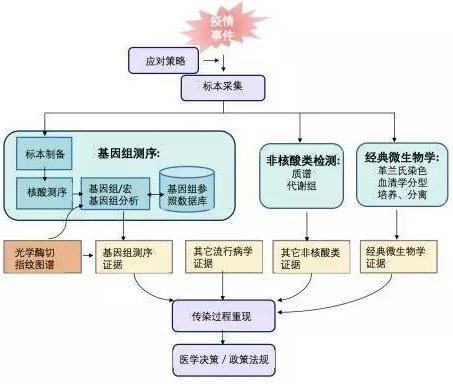
目前,借助于NGS技术,病原微生物基因组测序策略包括以下三类:
①基于宏基因组学的测序:对于环境或临床样本,这种方法可用来查明病原,辅助诊断,以及了解微生物构成的多样性。该方法检测标本中的所有核酸,包含宿主和病原 (包括细菌、病毒、真菌、寄生虫等), 不需要对病原微生物基因组有先验知识,因此可以快速应答新发的传染病威胁,如突发传染性疫情的检测与监测。
宏基因组测序法主要优势在于无需靶向扩增,因不需要预知病原基因组序列信息。但由于宿主与病原的序列同时测出,病原体序列占比极少,所以如何有效的去除宿主序列,对标本处理及信息分析技术有较高要求。同时,对于临床样本的检测,如何区分定植与感染,也需要大数据量样本累积及临床经验综合判断。如需对病原体序列进行深入分析 (耐药基因等),则需加大测序深度,其检测成本也有所提高。
华大基因采用宏基因组测序法,对临床不明原因发热、高度怀疑感染的血浆、脑脊液、肺泡灌洗液、痰液等样本进行检测,先后在不同样本中检测到了细菌、病毒、真菌、寄生虫等病原微生物,为临床提供了有力的证据。初步的比较研究发现,对于疑似血流感染样本,高通量测序技术的检测阳性率为传统培养方法的2倍左右。
②PCR扩增后测序:针对序列已知的病原体,先扩增富集该病原体基因片段之后再测序。可以用于对病原体耐药基因,毒力因子的分析。该方法的特异性、敏感性较高,测序成本较宏基因组方法更低。对于基因组较大的病原体,通过这种方法实现病原体全基因组测序会有一定困难。且该方法对于未知病源的感染无能为力。
③目标DNA区域捕获并测序:设计核酸探针 (生物素标记) 互补结合到待测病原体的基因组区域,从而捕获特定的病原体基因组片段,继而对这些片段进行测序。这种方法主要用于对基因组较大病原的特定基因进行分析。该方法由于能精准获得目标区域序列信息,较宏基因组特异性高,较PCR扩增子测序循环数少,因扩增引入的错误也相对较少。该方法探针设计时需要参考全基因组序列,故无法对序列未知病源进行鉴定。
(7)肠道微生物检测:肠道微生物也就是我们所说的“肠道菌群”,其数量超过人体自身细胞的10倍以上,对营养物质代谢、人体自身发育、免疫及疾病的产生等方面都起到极其重要的作用。很多研究结果都表明肠道微生物和多种疾病发病直接相关,比如癌症、肥胖、神经变性疾病等。
目前,国内肠道微生物微基生物检测可采用二代高通量测序(NGS)、三代高通量测序、PCR-DGGE等方法,对样本中微生物的DNA进行测定,并通过生信统计分析,对大量数据进行处理,揭示肠道中微生物的种类以及它们之间的相对丰度和进化关系;还可以通过实时荧光定量PCR方法,定量的研究肠道菌群,探讨微生物多样性,研究肠道微生物与环境间的相关关系;还可以通过厌氧培养,获得肠道微生物中的菌种,从菌株水平上研究肠道微生物的功能和作用。
NGS技术方面:研究人员基于16SrRNA/18SrRNA基因,利用二代测序(NGS)技术,获得庞大的数据信息,通过生物 信息学手段,来分析肠道生物多样性,通过统计分析,对大量数据进行PCA、PcoA分析,得出发病后样本间肠道生物的主要组成成分是否存在差异,并进一步通过RDA分析,找到与环境因子(疾病)相关的微生物群落组成,从而达到预防疾病发生的目的。
(8)疾病风险评估:目前,在美国为了实现技术上的革新,FDA正在对NGS制定新评价体系。通过NGS,研究人员可以通过一次检验就能知道一个患者是否携带有遗传突变,医生可以从海量的基因信息中迅速地获取患者的遗传信息。检测结果可用于诊断某种疾病和评估患病风险,并且可以帮助医生和患者判断是否适合采用哪种治疗方式。
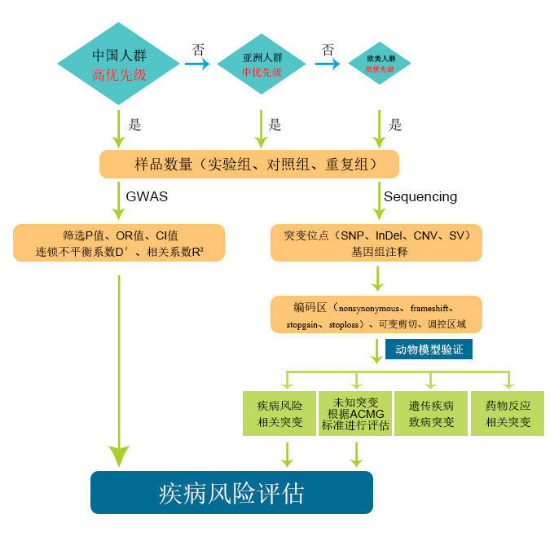
在评估每种疾病的患病风险时,首先查找国际上对该疾病的研究人群以及样品数量并进行筛选与评估。对于GWAS研究,根据P值、OR值、连锁不平衡系数D’等参数对突变位点进行评估;NGS相关的研究,需要对突变进行基因组注释,筛选有意义的突变,根据疾病数据库和ACMG标准和指南对突变进行分类以及致病风险评估。最后根据评估模型对疾病风险进行预测。
(9)肿瘤预防:下一代测序(NGS)由于高灵敏度、高通量、高度自动化等特性,近年来在疾病的研究和诊断中越来越多的被应用。下一代测序技术的发展为肿瘤分子生物学的研究、预防、治疗提供的新的手段。目前,市场上关于肿瘤的NGS基因检测主要有两类,一类是实体瘤的突变基因组panel测序,一类是外周血和尿液的液体活检。ctDNA是液体活检的一部分,液体活检还包括CTC和外泌体的检测。
国内最顶级的三甲医院,如协和医院病理科,医学科学院肿瘤医院,都已经能自主根据临床的需要,依托自身医学分子实验室的强大技术实力,开发实体瘤或者血液肿瘤的NGS panel。并为临床治疗提供专业的测序检测及专业的数据解读病理报告。
但专家指出,实体瘤NGS panel只是测量实体肿瘤的某一时刻的状态。这一点对初诊患者的用药指导是非常有及时必要的。但是如果对患者而言,从初诊指导用药到追踪肿瘤耐药进展的全过程,人体内肿瘤的状态是会随着时间不断变化的。另外考虑到一些发现时已经发生转移的癌症患者,如果仅仅取某个部位的癌组织,并不能反应患者的整体情况;还有一些已经实施减少肿瘤负荷的术后患者,再次对组织穿刺取样又不好操作。因此开展基于NGS的液体活检,以及基于FISH的CTC后期检测也有很强的临床需求。
(10)个体化诊疗:近年来,用NGS指导肿瘤患者的个体化治疗,已帮助很多肿瘤癌患者找到了治疗靶点。随着高通量测序(NGS)在肿瘤领域的应用、肿瘤个体化诊疗及全程管理、肿瘤临床数据解读及肿瘤多学科诊疗等规模的不断扩大,未来,国内NGS在肿瘤领域的应用前景广阔。
目前,市场上基于NGS平台的肿瘤个体化治疗产品集中在两个方向:一个是小panel,即检测明确几个基因,并且这几个基因都有明确的FDA批准药物,且有明确的伴随诊断,可定义为诊断类产品;另一个是大panel,包括大几十个,上百个甚至五六百个基因,这些基因中70%以上都是没有对应药物的,甚至没有明确临床意义的,可定义为咨询类产品。咨询类产品在内容上包括诊断类项目。做咨询类产品的公司非常多,几乎每一个新成立的以二代测序为基础平台的肿瘤个体化诊治公司都做大panel(多基因,咨询类),然后按照癌种(肺癌,结直肠癌,乳腺癌,胃癌)进行包装。
(11)预后监测:研究发现:ARMS(包括Super-ARMS)和ddPCR技术均只能检测已知突变,随着靶点研究的深入和靶向药物的增多,存在一定的技术瓶颈。NGS可检测未知突变,检测基因数量不受限,无疑是一个很好的补充。临床专家认为“在日后的诊疗中,由于越来越多的原发或继发性耐药的发生,未来驱动基因的检测决不是一次性就可解决的问题,需要伴随治疗过程进行动态的检测,NGS的应用必不可少,专家提出:未来,NGS还可用于检测已知的、多个平行临床可药物抑制的靶点;用于发现未知基因,探索疗效监测、预后判断和发现耐药机制等,其应用前景较好。
(1)无创产前检测(NIPT):临床应用逐渐成熟,市场空间远未饱和:无创产前筛查和诊断(NIPT)是一种非侵入性产前检测,即通过采集孕妇外周血提取胎儿游离DNA的方式,精准检测胎儿染色体异常的状况,具有精度高、风险低、无流产风险等优势。随着高通量基因测序技术(NGS)的不断成熟,基于NGS技术平台的NIPT检测得到了大规模的推广和应用。目前,在欧美等发达国家普遍开展,但在终或,仍处于起步阶段,市场空间远未饱和。
(2)胚胎植入前遗传学病学诊断:助力试管婴儿技术,提高生育率
胚胎植入前遗传学筛查(PGS):助力试管婴儿技术,提高生育率。是指进行试管婴儿(IVF)技术助孕时,胚胎植入着床之前,对早期胚胎进行染色体数目和结构异常的检测,通过一次性检测胚胎23对染色体的结构和数目,分析胚胎是否有遗传物质异常的一种早期产前筛查方法。传统的胚胎筛查方法一般是通过显微镜选择形态学指标较好的胚胎,但胚胎形态不能直接反应胚胎染色体是否正常,而染色体异常是导致妊娠失败和自然流产的重要原因,PGS则可以直接对胚胎遗传物质进行分析,判断染色体是否存在异常,从而挑选正常的胚胎植入子宫,以期获得正常的妊娠,提高患者的临床妊娠率。
(3)肿瘤诊断与治疗:处于起步阶段,极具潜力的NGS应用市场:目前,依托于NGS技术的肿瘤基因检测、治疗仍处于刚起步的阶段。近几年新发现的癌症基因和相关靶向药不断涌现,推动了癌症个体化治疗时代的到来。血液中循环肿瘤细胞(CTC)的发现有望使基于CTC单细胞测序技术的新型肿瘤诊断监测技术成为继无创产检之后的另一个重量级应用。
①应用优势:相较无创产前筛查,NGS测序在肿瘤诊断领域应用更加广泛,先发优势更加明显。首先,肿瘤领域的NGS测序是精准医疗最重要的组成部分,其应用将覆盖肿瘤的易感基因检测,早期筛查,疾病确诊,个性化用药指导,随诊与疗效评价等众多治疗环节,且肿瘤作为人类寿命的头号威胁其发病率和消费刚性远超产筛市场。其次,肿瘤诊断的高通量测序相对于无创产前筛查,其数据解读仍有很大的待开发空间。
据了解,利用目前的研究结果和DNA测序技术,可以对肿瘤患者高通量测序检测确认导致患者患病的基因或者受检者是否携带有肿瘤易感基因;寻找患者适用的肿瘤靶向治疗药物或者其他适宜的治疗手段。
|
对比项 |
传统方法 |
高通量测序 |
|
大片段检测 |
fish |
不受靠近片段的影响 |
|
突变检测 |
Sanger 一个一个基因检测 |
多个基因同时检测 |
|
检测灵敏度 |
Sanger 15-20 % |
可以达到0.5% |
|
表达量检测 |
免疫组化、芯片、qpcr |
完全定量 |
②劣势:目前,基于NGS新一代测序技术的肿瘤个体化医疗要实现临床常规化目前还面临诸多困难:
①由于新一代测序技术步骤复杂,对操作者的要求高,目前对于二代测序的标准化和质量控制尚未定义,经常需要一代测序和PCR后处理验证,这也是FDA一直未批准基于新一代测序的基因检测相关产品的重要原因之一;
②癌症致病机理也不甚明确,大部分是基因和环境的共同作用结果,目前已知的与癌症高度相关的可靠生物标记(Biomarker)和驱动基因数量有限,无法作为常规检测大面积适用;
③临床操作面临难度,肿瘤基因经常会产生抗药突变,此时肿瘤病人尤其是肺癌病人已无法满足癌组织取样活检的用量和频率,动态检测患者的病情困难重重;
④缺乏规范的临床使用指导方案,目前的临床肿瘤医生一定要遵循标准治疗方案,标准方案失败时才开始尝试。
近几年新发现的癌症驱动基因和相关靶向药不断涌现,推动了癌症个体化治疗时代的到来。血液中循环肿瘤细胞(CTC)的发现使未来基于CTC单细胞测序技术的新型肿瘤诊断监测技术将成为无创产检之后的另一个重量级应用。
(4)遗传病诊断:单基因遗传病检测为主要产品:单基因遗传病涉及多个学科,临床症状复杂,诊断较为困难,传统检测技术存在漏诊、误诊的风险,可能导致患者错过了最佳治疗时机。基因检测能够实现单基因遗传病的早发现、早干预、早治疗。目前已知的很多遗传病都属于单基因病,如血友症、色盲、多指、并指、苯丙酮尿症、佝偻病等等。

 400-1050-986
400-1050-986

