 市场资讯
市场资讯新闻资讯 更多+
(1)家用医疗器械及IVD领域:从全球范围来讲,近年来全球医疗器械市场继续保持稳步增长。2020年,新冠疫情在全球范围的爆发,使得监护仪、呼吸机、输注泵和医学影像业务的便携彩超、移动DR(移动数字化X线机)的需求量大幅增长,全球各国对医用防护用品、新冠检测盒、ECMO等医疗器械订单量激增,销售价格出现较大幅度上涨,部分医疗器械持续脱销。
2021年起,新冠抗原自测产品自在欧洲国家大量使用,成为疫情防控中的重要检测手段。2021年2月德国率先出台相关审批准入制度,随后奥地利、法国、比利时、荷兰等国分别推出抗原测试准入白名单通道。2021年底海外Omicron流行,美国、澳大利亚、日本等多个国家疫情反弹采用抗原自测产品进行防疫,产品需求迅速提升。美国政府采取“检测治疗”的防疫政策,即人们可以在药店接受检测,如果为阳性,可当场免费获得抗病毒药物。新冠抗原家用自测产品逐步成为防疫的常态化产品,这让诊断场景逐渐从中心实验室,向基层甚至C端渗透,实现即时、简便、家用。在新冠抗原自测市场规模爆发增长的带动下,IVD行业表现出了市场增速高,市场份额逐年扩大的特点,在医疗器械领域内脱颖而出。中国是主要抗原检测产品生产国家之一国内企业积极应对海外需求,快速提升产能,根据中国海关数据,2021年12月抗原产品出口环比提升146%。
从我国该行业发展情况来讲,新冠疫情对医疗器械行业有着深远的影响。主要表现包括:疫情将长期带动医疗基础设施市场扩容和基层下沉,并加速医疗器械行业国产替代;促使多国降低或免除医疗器械进口关税,加速我国医疗器械走出国门;促使行业审批加速,有利于减少企业审批费用、缩短产品审批周期。近年来,我国医疗器械行业市场规模不断扩大,预计2022年达12529亿元,2025年将达18414亿元。专家认为,随着产业发展政策环境持续优化,以及公众对医疗器械诊断精准化的需求日趋强烈,未来中国医疗器械行业市场规模,将会保持稳定增长态势。国家药监局发布的《2021年度医疗器械注册工作报告》显示,截至2021年年底,共批准新冠病毒检测试剂68个(包括34个核酸检测试剂、31个抗体检测试剂、3个抗原检测试剂),产能达到5130.6万人份/天,为常态化疫情防控工作提供了有力保障。同时,国家药监局还批准了基因测序仪、核酸检测仪、呼吸机和血液净化装置等16个仪器设备。截至2021年底,共批准108个新冠疫情防控医疗器械产品。
此外,工信部就《医疗装备产业发展规模(2021-2025年)》公开征求意见,指出要推动医疗装备产业高质量发展。政策的支持能帮助企业提升相关技术,推动中国医疗器械行业进一步发展。2020年,国内POCT(即时检验)行业在疫情背景下高速发展,增速达到了24.7%,市场规模在93亿元左右。预计到2026年,这个数字将超过260亿。
中金企信国际咨询公布的《家用医疗器械行业专项深度调研及“十四五”发展规划指导可行性预测报告(2022版)》
(2)新冠病毒抗原检测试剂行业市场现状:新冠病毒抗原检测试剂是新冠病毒检测的方式之一,一般用于感染早期。后疫情时代,多国在公认核酸检测为新冠病毒检测“金标准”的同时,也推广了抗原检测,将之作为一项有效补充。
抗原检测和核酸检测优劣势对比
|
名称 |
抗原检测 |
核酸检测 |
|
原理 |
一种抗原检测技术,利用病毒抗原和抗体相结合的原理,检测人的鼻腔分泌物内是否含有病毒抗原 |
一种基因扩增技术,利用聚合酶链式反应,检测咽拭子样本中特定的新冠病毒核苷酸片段 |
|
优势 |
操作简单,成本低,从测试到出结果只需要15-30分钟 |
检测结果准确,灵明度99%,漏检率低,是检测新冠阳性的金标准 |
|
劣势 |
敏感性较低(假阴性结果较多),尤其在无症状人群中,由于病毒量低,可能不会被检测到 |
成本较高,费时费力,需要专业实验室及操作人员 |
国外市场:国外早在2020年开始就已经开始普及新冠抗原检测试剂盒。近年来,随着omicron在全球感染量上升,我国的新冠抗原检测试剂在美国、欧洲部分国家、英国、以色列、新加坡等各国迅速占领市场,以万孚生物为例,该公司的新冠抗原检测试剂产品于2020年11月通过中国NMPA应急审批,成为国内第一批获得新冠抗原检测试剂注册证的企业,目前,该产品销售已经覆盖欧洲、亚洲、拉美、中东等区域超过100个国家。
当前我国多家企业自研、自产的新冠病毒相关产品(抗原检测、抗体、中和抗体)被列入商务部出口白名单,海外市场上甚至出现了“一盒难求”的现象。据了解,2020年全球新冠检测市场高达603亿美元,预计2021年达到844亿美元,2022年将突破1000亿美元,未来5年年均复合增长率将达到15%。
国内市场:就我国国内情况来看,2022年2月中旬以来,国内疫情呈现多点散发趋势,全国各地紧急开展了全员核酸检测,截至2022年3月22日13时,我国现有确诊267732例,全国共有高风险地区33个,中风险地区542个。
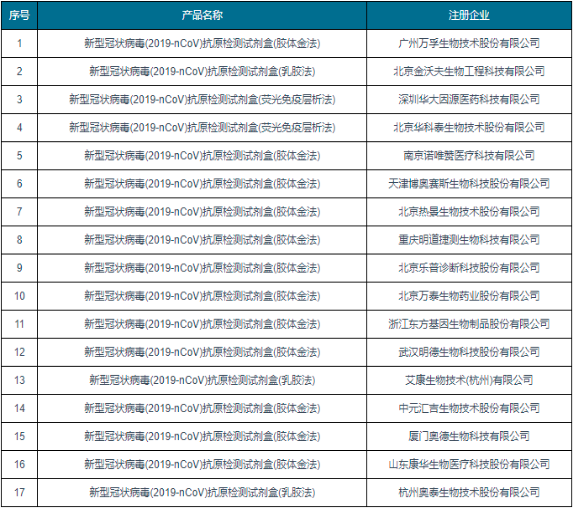
在我国疫情复发的局势下,为进一步优化新冠病毒检测策略,今年3月11日,国务院联防联控机制综合组决定在核酸检测基础上,增加抗原检测作为补充,制定印发《新冠病毒抗原检测应用方案(试行)》。次日,国家药品监督管理局发布通告,批准广州万孚生物、北京华科泰生物等企业的新冠抗原产品监测应用申请变更,这意味着新冠抗原测试产品在中国正式上市。根据国家药监局官网发布消息显示,截至3月18日,国家药监局已批准17个新冠病毒抗原检测试剂产品。
中金企信国际咨询公布的《全球及中国IVD市场全景监测调研及竞争战略可行性预测报告(2022版)》
中国国家药监局已批准新冠病毒抗原检测试剂分析
(3)产业发展前景:政策方面,疫情失控风险催化抗原检测政策出台。今年1月初香港第五波疫情爆发,至今疫情持续严峻。香港严重的疫情迫使特区政府开始大规模推广新冠抗原快速检测试剂应用,包括向特定群组免费派发快速抗原测试包,大力推行“自愿全民快速检测”,鼓励居民通过药店、网络等渠道采购抗原自测产品进行自检。香港的范例,使得相关防疫部门意识到新冠抗原检测对于整体防疫体系的重要性,今年3月11日,国务院新冠疫情联防联控组发布《关于印发新冠病毒抗原检测应用方案(试行)的通知》(以下简称《方案》),正式提出在核酸检测基础上,增加抗原检测作为补充。相应政策快速落地。
需求方面,根据《方案》规定,当前我国新冠抗原检测试剂的适用人群主要有三类:不具备核酸检测能力的基层医疗卫生机构接诊的出现新冠相应症状的人群;各类隔离观察人员,除按照现行方案开展核酸检测外,还需在前5天每天进行一次抗原检测;有自我检测需求的社区居民,可通过零售药店、网络销售平台等渠道,自行购买抗原检测试剂进行自测。

 400-1050-986
400-1050-986

