 市场资讯
市场资讯新闻资讯 更多+
(1)大Panel基因检测成为主流:肿瘤精准医疗基因检测Panel包含一组选定的基因或基因区域,这些基因或基因区域与已知或研究中的疾病或表型有关。根据检测基因数量的不同,可以分为小Panel和大Panel。小Panel针对少量基因,通常只覆盖单癌种相关通路上下游基因信息和常见肿瘤突变基因,通过PCR技术或高通量基因检测均可实现;大Panel则通常包含几十、几百甚至上千基因,覆盖癌种类型广泛,基因信息更为丰富,需要通过高通量基因检测方能实现。过往的基因检测与临床药物发展阶段以及可及性相适应,主要以单癌种相关的小Panel为主。随着对肿瘤基因组认识的不断加深以及诸如TMB、MSI等肿瘤免疫治疗新生物标志物的兴起,评价临床药效的分子标志物已经不再局限于单一或少量基因位点,利用高通量测序技术开展泛癌种大Panel基因检测逐步成为临床主流,具有以下优势:
1)全面覆盖罕见突变靶点:通常而言,临床上把发生率低于5%的靶点定义为罕见靶点,例如EGFR基因20外显子插入、ROS1基因融合、RET基因融合、MET基因14外显子跳跃突变、NTRK1/2/3基因融合等。随着靶向创新药物的持续上市,越来越多的罕见基因突变患者或者常见基因的罕见位点突变患者可以选择合适的药物进行治疗。以NTRK为例,对于国内常见的肺癌和肠癌,NTRK融合的发生率均低于1%。2018年11月,美国FDA加速批准拉罗替尼,用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤,其患者治疗客观响应率为75%;另一款针对NTRK靶点的广谱靶向药物恩曲替尼也已在欧美上市。肿瘤患者只有通过高通量大Panel基因检测才能全面覆盖肿瘤罕见靶点,获得更多靶向药物治疗的机会。
2)系统揭示肿瘤伴随突变:肿瘤突变的成因极其复杂,除了常见的驱动基因突变外,通常还会存在大量伴随突变。以EGFR突变为例,很多患者除了携带EGFR驱动突变以外,经常会同时伴有上下游通路或旁路的相关基因突变,如PIK3CA突变、PTEN突变、MET扩增等;携带这些伴随突变的患者可能会对EGFR靶向治疗产生原发耐药;除了EGFR基因上下游和旁路基因的突变以外,EGFR自身也可能会存在一些共突变的情形,如一些激酶结构域或非激酶结构域的点突变、EGFR扩增、EGFR融合等,这些EGFR共突变同样可能会对EGFR靶向疗效产生影响。因此患者如果单纯检测驱动基因突变,可能无法发现伴随突变或共突变的状态;通过大Panel基因检测,可以全面揭示肿瘤的伴随突变图谱,综合分析伴随突变对驱动基因突变的影响,能够为患者提供更为精确的用药指导。
3)大幅提高临床检测效率:如前所述,利用传统方法检测驱动基因变异存在假阴性可能性。例如,一项研究表明4,对于晚期结直肠癌患者,如果仅就单个热点基因突变进行检测其阳性检出率约为40%;如若进行小Panel基因检测,阳性检出率可增至65%;而进行大Panel基因检测,则可以在99%的患者中检测到驱动基因突变。再者,传统序贯检测可能会造成组织样本耗竭进而导致无法再进行后续基因检测,进而使患者错失潜在治疗机会。大Panel基因检测覆盖范围大、准确程度高,可以有效提升诊断效率,为病人争取宝贵治疗时间。
4)有效增强免疫治疗效果:如前所述,以PD-1/PD-L1单抗为代表的免疫检查点抑制剂在多种肿瘤治疗过程中表现出良好疗效,为许多患者带来了长期生存收益,但也存在临床响应率偏低,部分患者在免疫治疗后出现肿瘤快速进展情形即所谓“超进展”(Hyper progressive Disease,HPD)。因此在进行免疫治疗时,需要对诸如TMB、MSI等相关生物标志物进行检测,区分真正可以从免疫治疗中获益的人群,评估发生超进展的风险,实现精准施治。
TMB检测通过评估整体基因组的不稳定性间接反映肿瘤产生新抗原的能力,多项临床研究证实了其与免疫治疗疗效显著相关。由于小Panel基因检测位点较少,无法有效评估整体基因组的不稳定性,而覆盖1M碱基左右的大Panel基因检测的TMB结果与全外显子检测的TMB结果较为吻合,可以有效预测免疫治疗疗效。再如,MSI是另一个目前肿瘤免疫治疗中得到普遍认可的生物标志物,目前多种免疫治疗药物被批准用于MSI-H的肿瘤患者。高通量大Panel基因检测可以同步覆盖大量微卫星位点,能够有效克服小Panel基因检测位点较少而导致假阳性的固有缺陷。
中金企信国际咨询公布的《高通量测序行业市场发展动态监测及投资战略可行性评估预测报告(2022版)》
(2)从肿瘤组织活检到液体活检:肿瘤患者组织中细胞富集,以此为样本进行基因检测准确程度较高,但也存在不足。首先,组织活检作为一种有创取样方式,临床上可能存在受限情形(如组织样本量不足、肿瘤发生位置风险较大实际难以取样等),对于多节点的连续组织活检则更加难以实现。其次,肿瘤组织具有高度异质性,往往远处转移病灶和原发病灶具有不同的特征,单次获取特定组织进行活检未必能够全面准确反映肿瘤组织状况和进展信息。第三,在需要动态连续评估用药效果等场景下,患者依从性较低,难以连续便捷取得肿瘤样本。
组织活检与液体活检比较分析
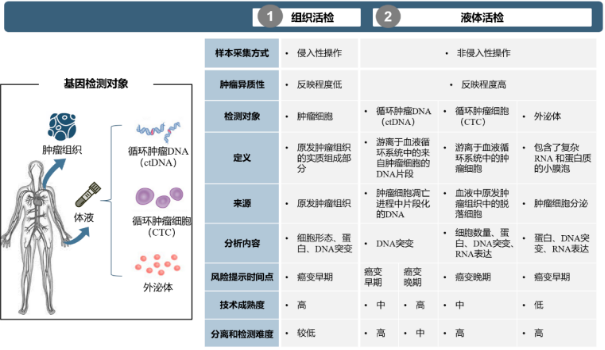
肿瘤学家很早就意识到癌细胞会通过血液扩散,因此致力于开发灵敏可靠的检测技术。液体活检作为一种非侵入性技术,主要检测患者体液标本中的肿瘤相关物质,具有无创、便捷和安全的优势。循环肿瘤DNA(Circulating Tumor DNA,ct DNA)是液体活检最重要的生物标志物,系肿瘤细胞释放到血液循环中的DNA片段,能够克服肿瘤时空异质,准确刻画患者肿瘤细胞的分子特征和进展信息,开辟了高通量基因测序技术临床应用新场景,使得肿瘤全周期动态监控成为可能。具体而言,对于肿瘤治疗患者,ct DNA液态活检意义在于动态监测肿瘤进展、实时评估治疗效果、及早提示耐药情形,目前已有临床应用。对于早期或潜在患者,ct DNA液态活检旨在早筛早诊肿瘤,以便密切随访、及时干预,但也面临现有技术尚不足以灵敏可靠检测早期患者血液样本中痕量ct DNA的问题,目前仍属前沿探索领域。
1)肿瘤复发监测:恶性肿瘤通常具有无限生长、浸润和转移的固有特性,许多患者即便经过手术切除和药物治疗后仍有可能复发。例如,胶质母细胞瘤几乎在所有患者中复发,卵巢癌复发率也高达85%。因此,以术后肿瘤病人为例,长期有效的疾病进展监测尤为关键,而现有传统的肿瘤标志物测定以及医学影像学检查均存在灵敏度和特异性弱、前瞻性预警提示作用差等问题;相比而言,ctDNA的半衰期短、敏感性强,能够实时反映肿瘤动态变化,正在越来越多地应用于临床实践。
肿瘤复发监测临床获益分析
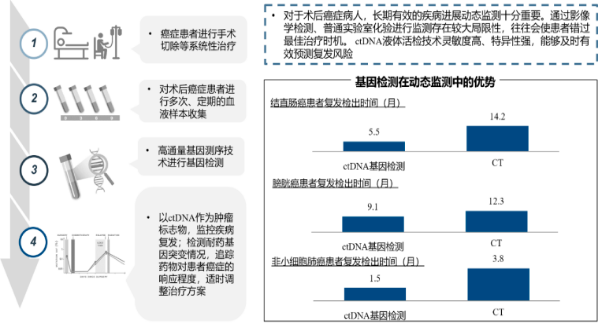
肿瘤患者在治疗中或治疗后体内仍有残留的恶性肿瘤细胞存在,即所谓微小残留病灶(Minimal Residual Disease,MRD);这些残留的肿瘤细胞会不断向血液循环释放ct DNA。基于ct DNA液体活检技术的患者术后MRD检测评估,可优于传统影像学方法预测肿瘤复发,具有重要意义。当然,患者经过系统治疗之后其肿瘤病灶和症状往往得到明显缓解,因此出现微小转移复发时,需要开发使用更高灵敏度的液体活检技术,方有可能捕捉到肿瘤进展的微弱信号。
目前MRD检测最成熟的应用当属血液肿瘤,已成为美国国家综合癌症网络(NCCN)临床标准实践的一部分。2018年,全球首个通过美国FDA批准的MRD检测产品Clono SEQ正式上市,该产品基于高通量测序技术检测急性淋巴细胞白血病和骨髓瘤中的MRD,帮助医生评估患者预后以及动态监测复发情况。
2)肿瘤早筛早诊:众所周知,绝大多数的恶性肿瘤早期并无明显症状,发现时通常已是中晚期;肿瘤早筛早诊可以显著延长患者生存周期、改善生活质量、降低治疗成本。例如,美国癌症协会数据显示5,对于非小细胞肺癌患者,原发肺癌5年生存率为63%,远处转移肺癌5年生存率仅为7%。肿瘤早筛早诊是癌症防控的有效手段,具有重要科学意义和社会价值。
肿瘤早筛早诊临床获益分析
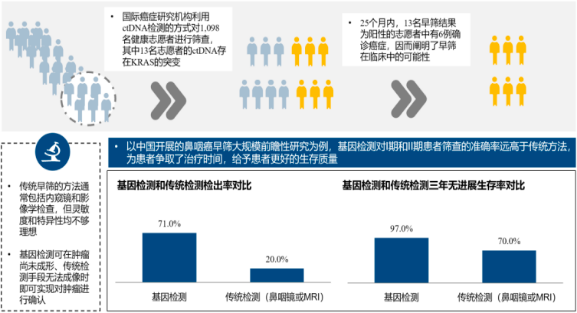
与肿瘤用药指导以及复发监测应用场景相比,基于液体活检的肿瘤早筛早诊技术具有更高技术壁垒。如前所述,ct DNA是液体活检最重要的生物标志物,系循环DNA(Cell-Free DNA,cf DNA)的一种,是肿瘤细胞坏死、凋亡或者正常分泌到血液中的DNA片段,携带肿瘤相关基因变异信息、能够及时准确反映患者癌变情况。但对于早期肿瘤而言,血液中绝大部分为健康细胞释放出的cf DNA,ct DNA含量极低;2017年发表在Nature杂志上一项研究6指出,携带1cm肿瘤的早期患者ct DNA丰度一般在0.006%左右。而现有高通量测序技术所能达到的最低检测限通常在0.1%~0.5%之间,难以满足早筛的临床需求。除此之外,另一技术难点在于如何就检测到的阳性结果进行器官定位。由于绝大部分原癌基因和抑癌基因的突变都没有组织特异性,均与多种癌症的发生相关(例如BRAF基因突变可能存在于黑色素瘤、甲状腺乳头状癌、结直肠癌和非小细胞肺癌等多种情形中)。倘若通过ct DNA液体活检仅能知晓是否罹患肿瘤却无法判断原发病灶位置,则除了徒增患者烦恼以外并无实际意义。针对上述技术瓶颈,业内探索了多种技术路线,主要包括cf DNA甲基化测序、ct DNA基因突变结合血浆蛋白等生物标志物检测、cf DNA低深度全基因组测序结合血浆肿瘤标志物检测等。
需要说明的是,无论哪种技术选择,单一生物标志物的预测性能总有局限,惟有多个维度的信息综合分析,才有可能突破检测灵敏度和特异性上限。在此过程中,应当充分发挥大队列研究的数据资源优势开展无偏好的探索性研究,采集多组学数据借助机器学习方法寻找分类效能最优特征组合,形成一套跨平台多维度数据综合分析算法,以期大幅提高癌症早期筛查和诊断的准确性。与此同时,肿瘤早筛早诊不仅是一个医学问题,还与公众意识、卫生成本、医学伦理密切相关,应当注重前沿技术的合理临床应用,而不宜盲目绝对地推广至所有健康人群。
(3)伴随诊断逐步嵌入药物开发:随着肿瘤生物学研究的进展,一些新的作用机制、作用靶点的抗肿瘤药物不断涌现,相关研发人员意识到不同个体对同一药物的反应存在差异。宿主、肿瘤和外在因素会影响个体对抗肿瘤药物的反应。使用伴随诊断试剂检测肿瘤患者生物样本中生物标志物状态,能够为抗肿瘤药物的安全和有效使用提供重要信息;在抗肿瘤药物研发过程中,通过对疾病相关生物标志物的检测,有助于筛选出适合某类药物治疗的特定人群。部分抗肿瘤药物的开发过程会同步开发伴随诊断试剂,其临床试验尤其是其关键性临床试验过程会使用伴随诊断试剂。抗肿瘤药物临床试验既可以支持抗肿瘤药物上市,亦可作为伴随诊断试剂伴随用途的确认证据支持其上市。具体可能涉及情形如下:
1)在抗肿瘤药物的开发过程中同步进行伴随诊断试剂的开发,在药物非临床及临床研究过程中,通过与伴随诊断试剂共同验证确认,确定药物可能安全有效的治疗人群。抗肿瘤药物与伴随诊断试剂共同进行研究的数据作为二者上市的支持性证据。
2)抗肿瘤药物临床试验中采用临床试验分析方法进行病例的生物标志物分析,相应的伴随诊断试剂开发相对滞后;相关研发人员可以将其作为后续伴随诊断试剂开发的基础或作为后续该药物的候选伴随诊断试剂。
3)如抗肿瘤药物在开发过程中,针对其伴随诊断试剂的需求有已上市产品,在相关研究人员进行充分的验证和确认的基础上,可选择已上市产品作为该药物的伴随诊断试剂,参与药物的研发过程。抗肿瘤药物及伴随诊断试剂的研究结果可作为药物上市及伴随诊断试剂变更增加预期用途的证据。

 400-1050-986
400-1050-986

