 研究报告
研究报告新闻资讯 更多+
(1)细胞质量安全控制、评估和检测行业的形成原因和历程:生物制品质量安全控制、评估和检测行业致力于为生物制品企业、医疗机构、科研院等提供从生物制品研发、生产、申报到上市的全过程质量安全控制的服务,主要包含细胞检定服务、病毒清除工艺验证服务和细胞建库与保藏服务。其中,细胞检定服务是质量安全控制、评估和检测的基础和核心环节。
由于生物制品本身特定以及制备过程的影响,较容易受到污染。一方面,生物性原材料有可能携带病原微生物,如细菌、支原体、分枝杆菌、内源性病毒和外界污染的病毒,甚至培养过程中所用的物料也是污染微生物生长的良好培养基。如果原材料和相关物料受到病原微生物污染,则生产出来的生物制品将存在安全性隐患。另一方面,为提高产品效价(免疫原性)或维持生物活性,常需在产成品中加入佐剂或保护剂,致使部分检验项目不能在制成成品后进行。因此,生物制品研发生产过程中的质量安全控制就显得尤为重要。
近年来各项法律法规也从法律层面确立了生物制品需要经过细胞质量安全控制、评估和检测的要求。根据《药品管理法》《药品注册管理办法》,申请药品注册,应当提供真实、充分、可靠的数据、资料和样品,证明药品的安全性、有效性和质量可控性。国家药监局发布《<药品生产质量管理规范(2010年修订)>生物制品附录修订稿》也明确提出对生物制品原辅料、中间产品、原液及成品进行检验。在生物制品迅速发展,市场规模不断扩大的背景下,细胞质量安全控制、评估和检测行业同样迎来了快速发展。
《中华人民共和国药典》分为四部分出版,其中三部专门收载生物制品标准,规定了生物制品原辅料、中间产品、原液及成品进行检验的质量标准。我国生物制品质量安全控制、评估和检测行业的发展离不开药典对于生物制品质量标准和检定方法技术规范的不断完善。
①早期萌芽阶段(1950-1977年):1950年10月,经国务院文化教育委员会批准成立“中央人民政府卫生部生物制品检定所”,负责全国生物制品的检定和组织起草修订生物制品制造及检定规程等工作。1952年,卫生部批准颁布《生物制品法规》(修订本,1952年出版),该法规是我国第一部生物制品国家法定标准。而第一部《中华人民共和国药典》于1953年出版,对收载品种、专用名词、度量衡问题等做出了规定。
1963年、1977年、1990年、1985年、1995年第二版至第六版《中华人民共和国药典》发布,期间1993年卫生部将药典委员会常设机构从中国药品生物制品检定所分离出来,作为卫生部的直属单位。但由于我国生物制品产业还处于萌芽阶段,我国生物制品质量控制规范主要依据《生物制品制造及检定规程》。该规程于1959年1月由卫生部批准颁布,其中收载了8个生物制品总则规程,15个细菌制品规程,5个病毒制品规程,并不断更新增补。这一阶段《中华人民共和国药典》对生物制品质量控制、评估、检测服务规范未进行明确要求。
②专业化发展阶段(2002-2010年):2002年10月,第八届国家药典委员会内增设了生物制品细菌制品、病毒制品、血液制品、重组技术制品、体细胞治疗和基因治疗、体外诊断试剂6个专业委员会,负责各类生物制品国家标准的起草、修订工作。并决定将《中国生物制品规程》并入《中华人民共和国药典》三部,正式作为生物制品国家标准。在国家的重视和研发的持续投入下,生物制药产业的逐步发展,国内生物制品市场规范化、专业化程度不断提高,细胞质量安全控制、评估和检测进入了专业化发展阶段。
2005年,《中华人民共和国药典》(第八版)发布,三部收载品种101种,新增44种,修订57种,收载附录134个,对药品的安全性问题更加重视,增订了逆转录酶活性检查法、人血白蛋白铝残留检测法等。
2010年,《中华人民共和国药典》(第九版)发布,现代分析技术得到进一步扩大应用,进一步扩大收载成熟的新技术和方法。对药品质量可控性、有效性的技术保障得到进一步提升。
③快速发展阶段(2011年以后):2015年6月颁布2015年版《中华人民共和国药典》三部(第十版),规定细胞检定主要包括以下几个方面:细胞鉴别、外源因子和内源因子的检查、成瘤性/致瘤性检查等。必要时还须进行细胞生长特性、细胞染色体检查、细胞均一性及稳定性检查。这些检测内容对于MCB细胞和WCB细胞及生产限定代次细胞均适用。细胞库建立后应至少对MCB细胞及生产终末细胞(EOPC)进行一次全面检定,当生产工艺发生改变时,应重新对EOPC进行检测。每次从MCB建立一个新的WCB,均应按规定项目进行检定。
该药典完善了药典标准体系的建设,整体提升质量控制的要求,进一步扩大了先进、成熟检测技术的应用,药用辅料的收载品种大幅增加,使《中华人民共和国药典》的引领作用和技术导向作用进一步体现。
2020年6月《中华人民共和国药典》三部(第十一版),紧跟国际先进标准发展的趋势,密切结合我国药品生产实际,不断提升保障药品安全性和有效性的检测技术要求,强化了质量标准的科学性,关注全过程质量控制,并结合生物制品的特点,强调检测评估的量化指标控制,对病毒的检测多采用定量PCR(Q-PCR)技术,部分病毒使用病毒颗粒电镜定量高新技术,实现了病毒检测从定性检测到定量检测质的转变,显著提升了国内病毒检测水平。
近年来随着技术的更新迭代,《中华人民共和国药典》不断与时俱进,持续吸纳运用新技术,提高了生物制品细胞质量控制、评估和检测服务的行业门槛,推动了行业的高质量发展。
中金企信国际咨询公布的《2023-2029年细胞质量检测及生物安全评估行业市场全景调研分析及投资可行性研究预测报告》
(2)细胞质量安全控制、评估和检测的发展现状:目前全球细胞质量安全控制、评估和检测市场中,主要是由独立第三方检测机构为下游生物制品公司提供检定服务。全球范围内各第三方独立检测机构严格遵守由ICH(国际人用药品注册技术协调会)发布的质量政策、ISO发布的质量手册规定、美国药典(UnitedStatesPharmacopoeia)、美国FDA监管事务办公室发布的ORA质量手册、欧盟药品管理规则、欧盟人用兽用药品良好生产规范指南、中华人民共和国药典等质量规范,在生物制品的研发、申报、生产等各个阶段提供检定评估服务。2020年全球医药安全性评估外包市场已达到27.82亿美元,其中有60%以上的外包医药安全性评估需求是与上述药品审评法规相关。
中国细胞质量安全控制、评估和检测市场规模2021年达到20.8亿元人民币,预计2022年将接近30亿元。未来随着下游生物制药企业、细胞治疗和基因治疗等相关产业细胞质检服务的需求不断增长,研发环节中对生物制品安全性要求的不断提高,未来细胞质量控制、评估、检测服务市场规模将不断扩增,预计到2030年增长至250亿元人民币,未来复合年增长率可达31.8%。
2019-2030年中国细胞质检和生物安全评估市场规模及预测
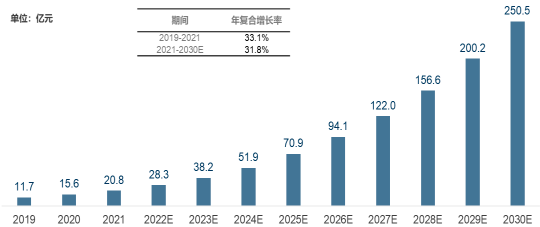
数据统计:中金企信国际咨询
而与细胞、基因治疗方式相关的细胞质量安全控制、评估和检测市场规模也在迅速发展。
目前国内研究阶段的干细胞质检市场规模由2019年的2.2亿元人民币增长至3.5亿元人民币,复合年增长率达到25.7%。未来,随着国家对干细胞治疗领域的进一步支持和大量研究经费的投入,干细胞疗法临床研究数量将持续增加,研究阶段的干细胞质检市场规模也将进一步扩大,预计到2030年市场规模将达到40亿元人民币,复合年增长率可达31.2%。在此背景下,我国干细胞基础研究向临床转化的速度以及干细胞产品化的速度也将进一步加快。目前,干细胞治疗产品在人类疾病治疗中的地位和价值已经初步显现,尤其是在一些传统药物或治疗手段较难治愈的疾病领域(如恶性肿瘤、神经退行性疾病、糖尿病、重症肝病、移植物抗宿主病、系统性红斑狼疮等)显示出了明确的疗效,或将成为弥补传统治疗不可或缺的重要手段。未来,干细胞疗法在临床推广以及干细胞产品在中国上市后,由于每一批次干细胞产品都需要进行质量检测和放行检测,与治疗相关干细胞质检市场规模将会迅速增长。预计2030年干细胞治疗相关的质检市场将达到130亿元人民币,干细胞治疗、研究相关的市场规模合计将达到170亿元人民币。
2019-2035年中国干细胞质市场规模及预测
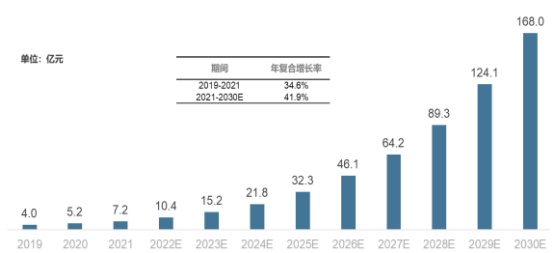
数据统计:中金企信国际咨询
2021年,首批CAR-T细胞疗法产品获得国家药监局批准并在中国推出,当年CAR-T细胞质检市场规模约为1.8亿元人民币。未来,随着CAR-T细胞质检市场规模将随CAR-T疗法市场的扩大持续迅速增长,预计到2030年市场规模将达到14.97亿元人民币,复合年增长率可达26.9%。
2019-2030年中国CAR-T细胞质检市场规模现状及预测
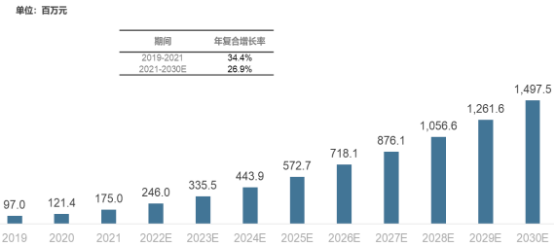
数据统计:中金企信国际咨询
同时,对中国的生物制药企业而言,选择海外检测机构需要面临高昂的费用、送样时间成本高、沟通不便等问题;选择中国检测机构能够避免跨境运输、进出口报关等不可控风险。随着国内检测机构检测能力的提高,越来越多的检测项目能够在国内企业实现检测,并且考虑到检测费用、送样环境,及节省下的研发时间等因素,未来中国独立细胞质量控制、评估、检测服务市场还将会有巨大的增量。

 400-1050-986
400-1050-986

