 市场资讯
市场资讯新闻资讯 更多+
医药合同服务外包行业概览:医药行业全产业链涉及研发、生产、流通三大主要环节,为降低成本,提高效率,制药企业将全产业链中的部分环节外包给外部专业供应商来完成,即制药企业集中做自己擅长的核心领域,将本来需要企业内部完成的非核心领域,以合约的方式交给专业、高效的外部供应商来完成,从而形成医药合同服务外包行业。根据医药行业全产业链拆分,传统医药合同服务外包包括研发外包(CRO)、生产外包(CMO/CDMO)、销售外包(CSO)三大外包服务,其中CRO和CMO/CDMO是医药合同服务外包最主要的两大服务。
中金企信国际咨询公布的《医药合同服务外包行业市场发展动态监测及投资战略可行性评估预测报告(2022版)》
(1)创新药医药合同服务外包:创新药研发从药物发现到候选药物选择,候选药物安全性及有效性评估,最终获得上市批准进入市场,药品研发流程一般包括药物发现、药学及临床前研究、临床试验研究、上市及后续跟踪研究四大环节。
药物发现位于研发流程前端,侧重于候选药物的选择,主要过程包括靶点鉴别、靶点确定、先导生成、先导选择等。与后续研发阶段相比,药物发现“成本高,风险大,周期长,回报低”,如何缩短研发周期、提高效率一直都是药物发现领域致力于解决的问题。当前,中国药物发现环节多集中于高校实验室及头部创新药企业实验室内完成。
药学及临床前研究主要包括原料药研究、制剂研究、质量及稳定性研究、药理和毒理研究等。在动物体内和体外进行候选药物测试、评估,旨在:①研究用药后机体如何吸收、分布、代谢及排泄;②进行安全性及毒理学评估;③检测潜在药效。临床研究及注册即候选药物获得临床批件后,可在人体进行安全性及有效性评估阶段,该阶段需要花费大量时间,且平均成功率不超过10%。临床研究一般包括I-III期临床研究,I期临床一般针对健康志愿者测试药物耐受性、剂量;II期临床主要对药物安全性和初步疗效进行评估;III期临床则进一步扩大受试者数量确定药物疗效。I-III期临床显示具有很好安全性、疗效方可提交上市注册申请。获得上市销售批准后,制药企业还需进行IV期临床进一步评估更多人口的安全性。
药品研发过程中生产环节包括临床前和临床研究阶段进行的早期生产以及药品上市后商业化大规模生产。早期生产主要包括化学、制造和控制(CMC)服务。商业化生产包括药品批准后根据生产要求大规模生产。
(2)仿制药医药合同服务外包:仿制药的结构、理化性质也比较明确,不需重新对化合物的结构进行筛选研究工作,结构和理化性质研究主要在于和已上市产品进行比较研究和验证。由于原研药已上市,其剂型、所用剂量已经明确,剂型和规格已确定,对于仿制药CRO企业来说,只需证明仿制药与原研药的一致性,一般情况下不需要重新进行剂型选择方面的研究、剂量和规格的探索,但是需要进行详细的处方、工艺的研究工作,并且需要和原研药进行比较。尤其是特殊的剂型,需要进行全面、深入的处方工艺的筛选研究。对于仿制药来说由于主成分结构和理化性质已经明确,治疗效果与毒副作用已知,研发工作重点在于工艺或处方的相关质量研究,选择适宜的方法,并对新产生的杂质进行定性和定量的研究,制定合理的限度,确定标准中合理的考察项目。
仿制药临床试验一般是指BE试验(生物等效性试验),其目的是为了保证仿制药具有与参比试剂(原研药)相同的临床治疗效果,是仿制药批准上市的基础,如无法开展BE试验,则需要开展验证性临床试验。
在国务院政策指导下,原CFDA相继发布《关于落实<国务院办公厅关于开展仿制药质量和疗效一致性评价的意见>有关事项》、《关于仿制药质量和疗效一致性评价工作相关事项的公告》等文件,要求2018年底前药企须完成基药目录中289个品种,17,740个批准文号或注册证号的一致性评价。
(3)MAH制度下医药合同服务外包:MAH制度将上市许可和生产许可分开,允许不具备生产、销售条件的企业、研究机构通过委托生产、销售的方式成为上市许可持有人,对药品从研发到生产到销售全产业周期负责。MAH制度是中国医药行业改革的一大重点,其塑造市场要素灵活化,推动上市主体多样化,在此背景下,MAH持证转化服务机构以新型管理外包服务(SMO)的形式参与到医药合同服务外包全产业链。其通过药品研发企业、生产企业及销售企业数据库建立持证转化中心,将有外包需求的企业纳入其中,打通从委托生产到上市销售所需要素。
(4)全球医药合同服务外包行业发展情况:全球医药合同服务外包市场规模已超千亿美元,医药合同外包市场前景可观。2015年至2019年,全球医药合同服务外包市场规模从1,003亿美元增长至1,497亿美元,五年复合增长率达到10.5%,其中CRO市场规模从443亿美元增长至626亿美元,五年复合增长率达到9.0%,CMO/CDMO市场规模从560亿美元增长至871亿美元,五年复合增长率达到11.7%。预计未来五年,全球医药合同服务外包市场规模将以10.0%的速率持续增长,并于2024年达到2,407亿美元。市场规模得以持续扩大主要得益于:①全球医药研发投入持续加大;②创新型中小生物制药企业兴起,外包需求增加;③欧美传统产能向亚太新兴市场转移。
2015-2024年全球医药合同服务外包市场规模现状及预测

数据统计:中金企信国际咨询
①全球医药研发投入持续加大:医药合同服务外包产业发展与医药研发投入呈正相关,研发投入加大将推动制药企业寻求外包服务。2015年至2019年,全球药品研发支出费用从1,498亿美元增长至1,823亿美元,五年复合增长率达到5.0%,其中临床研究费用占比超过60%,是全球医药研发支出最大部分。预计未来五年,全球药品研发支出费用将持续提升,并于2024年达到2,270亿美元。
2015-2024年全球药品研发支出明细分析
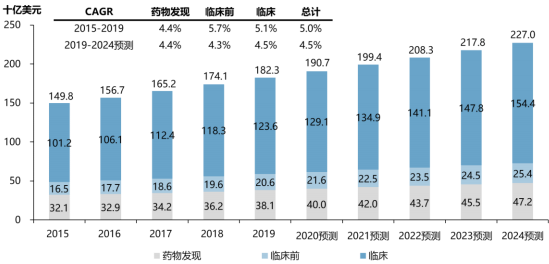
数据统计:中金企信国际咨询
②创新型中小生物制药企业兴起:现阶段,创新型中小生物制药企业已成为全球制药行业重要组成部分,其市场影响力不可小觑,并逐渐成为全球医药市场创新主力。从FDA批准上市新药不同类型企业占比情况上看,中小型制药及生物技术初创企业占比已从2009年的31%提升至2019年的64%,预计未来这一占比将持续提高。
中小型生物制药企业一般成立时间较短,产品线较为单一,生产配备能力不足,属于轻资产产业,为了降低成本、提高效率,中小型生物制药企业对研发、生产外包的依赖程度较高,更愿意与医药合同服务外包企业合作。中小型生物制药企业对外包产业需求的扩容明显推动全球医药合同服务外包行业的快速发展。
③欧美传统产能向亚太新兴市场转移:医药合同服务外包产业最早兴起于欧美发达国家,截至目前,全球2/3的产能仍然集中在欧美地区。全球医药合同服务外包行业集中度较低,排名前5的CRO企业市场份额约30%,CMO企业市场份额约15%。排名靠前的医药外包企业欧美业务相对已经饱和,开始寻求新兴市场。相比欧美地区,亚太地区更具成本优势,且科技发展为其储备大量人才资源,CMO企业产能扩建不断向亚太地区转移。与此同时,在政策推动、技术进步等多因素推动下,亚太地区制药企业发展迅速,研发创新也为CRO企业带来机会。
(5)中国医药合同服务外包行业发展情况:
①传统医药合同服务外包行业发展情况:传统医药合同服务外包行业包括CRO和CMO/CDMO两大领域。中国传统医药合同服务外包市场规模从2015年的39亿美元增长至2019年的98亿美元,五年复合增长率达到25.9%,其中CRO市场规模从2015年的26亿美元增长至2019年的68亿美元,五年复合增长率达到27.2%,CMO/CDMO市场规模从2015年的13亿美元增长至30亿美元,五年复合增长率达到23.3%,增长速率远超全球水平。预计未来五年,中国传统医药合同服务外包行业市场规模将持续增长,并于2024年达到329亿美元。市场规模得以持续扩大主要得益于:A.医药研发投入持续加大;B.传统医药合同服务外包市场渗透率提高;C.MAH制度推动国内CRO市场扩容。
2015-2024年中国传统医药合同服务外包市场规模分析

数据统计:中金企信国际咨询
A.医药研发投入持续加大:得益于政府创新激励优惠政策、本土制药企业研发能力提升、创新药不断向中国市场引进,中国制药行业的研发支出从2015年的104亿美元增长至2019年的211亿美元,五年复合增长率为19.2%,预计到2024年研发支出将达到476亿美元,2019-2024年的复合增长率为17.7%。
2015-2024年中国药品研发支出明细分析

数据统计:中金企信国际咨询
B.传统医药合同服务外包市场渗透率提高:得益于中国政策支持、医药合同服务外包体系不断完善、中小型生物制药企业兴起,传统医药合同服务外包市场需求提高,其市场渗透率从2015年的27.5%提升至2019年的34.7%,在市场需求的持续作用下,预计医药合同服务外包市场渗透率将持续提升,并于2024年达到49.7%。虽然与美国相比还有一定差距,但中国传统医药合同服务外包市场渗透率增速远高于美国。
2015-2024年中国传统医药合同服务外包市场渗透率分析

数据统计:中金企信国际咨询
C.MAH制度推动国内CRO市场扩容:MAH制度允许不具备生产、销售条件,但具有创新实力的研究机构成为上市许可人提交上市申请,让其享有技术创新带来的最终市场收益,最大程度上激发研究机构的药品创新能力。在此政策背景下,资源配置得到优化,注册申请、委托生产、许可转让、集团持有、委托销售等多要素得到释放,促进医药外包行业增长。
a.临床前研究:临床前候选化合物确定后,需要按照相关国家的药政法规对其进行系统的临床前开发研究。一般而言,药物的临床前开发研究包括药学研究和药物评价研究两个部分,其目的是系统评价新的候选药物,确定其是否符合进入人体临床试验的要求。药学研究(CMC)包括理化性质及纯度研究、成药性研究、原料药与制剂工艺研究、质量标准研究及稳定性研究等;药物评价研究包括在动物体内的药效学评价研究、安全性评价研究和药代动力学研究等。在临床前开发研究完成后,临床前候选化合物经过监管部门审批备案后成为临床在研新药。
CMC申报是药品申报资料中的重要组成部分,是仿制药研发流程的核心环节。由于仿制药的申请要求其与原创药具有一致性,无论在剂型、规格、给药途径、质量、药效特征以及适应症方面都应是等同的。相比于创新药,仿制药的申请一般不需要对其进行复杂且昂贵的动物试验和临床研究,但是对其安全及有效性的要求却更为严格,仿制药物的CMC研究与临床BE相对明确且严格。药学研究得益于近年来医疗健康行业持续发展,全球CMC市场由2015年约65亿美元增长至2019年的96亿美元,预计到2024年将进一步增加至153亿美元,2019年至2024年的复合增长率为9.7%。
2015-2024年全球CMC市场规模现状及预测

数据统计:中金企信国际咨询
与全球CMC市场相比,中国CMC市场仍处于相对早期阶段,过去五年市场规模从2015年的5亿美元增长至2019年的10亿美元,年复合增长率达到21.7%。得益于仿制药一致性评价工作的持续推进、中国制药行业的快速发展,未来五年,中国CMC市场将以24.6%的增长率快速发展。
2015-2024年中国CMC市场规模现状分析
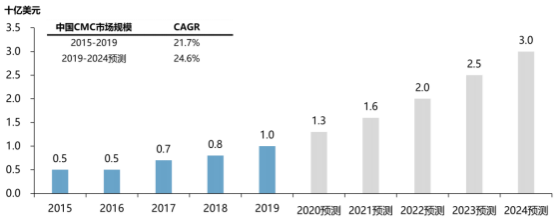
数据统计:中金企信国际咨询
b.临床研究:临床研究市场主要包括临床试验操作、数据管理及统计数据分析、现场管理与患者招募服务。全球临床试验数量由2015年的2,137项增长至2019年的6,939项,临床试验数量的增长带动全球临床研究市场规模从2015年的约291亿美元增长至2019年的415亿美元,预计2024年将增长至622亿美元。
中国自2017年加入ICH后,紧跟药品注册相关条例。ICH为旨在统一各国有关药品开发及注册的技术及监管规定的组织。因此,越来越多的全球生物制药企业在中国进行多中心临床试验。中国临床试验数量从2015年的339项增加至2019年的1,031项,临床试验数量的增长带动中国临床研究市场规模快速增长。在过去5年中,中国临床试验研究市场规模从2015年的约13.2亿美元增长至2019年的36.9亿美元,预计2024年将增长至137.0亿美元。
(6)医药合同服务外包行业发展趋势分析:
1、医药合同服务外包市场向中国转移:中国医药市场规模呈现快速增长趋势,创新药研发费用增长趋势远高于全球水平,吸引更多外资企业进入中国市场。从成本上看,中国整体基础设施建设、人力成本较低,中国受试者群体庞大,中国平均每次病人随访费用远低于美国、英国等国家。天然的成本优势也吸引更多外资企业选择中国作为战略发展区域。从政策上看,伴随MAH制度的落地、专利保护制度的完善、鼓励创新药发展相关政策实施,中国政府通过完善政策环境吸引外资企业进入中国市场。在政策完善、研发成本优势明显、本土医药合同服务外包企业实力增强的驱动下,全球医药合同服务外包产业链开始向中国转移。
不同国家临床试验招募地点密度比较

数据统计:中金企信国际咨询
不同国家平均每次病人随访的花费(单位:美元)
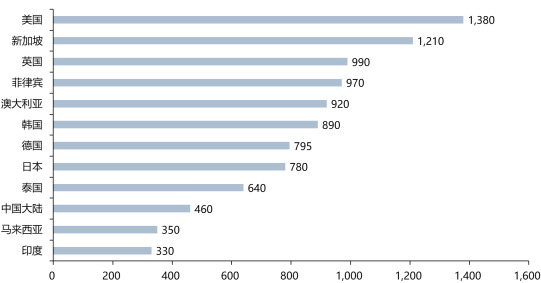
数据统计:中金企信国际咨询
2、行业集中度有望提升:医药合同服务外包行业是最近20年发展起来的新兴行业,最早由外资企业在中国投资设立分支机构发展而来。中国本土企业在此过程中逐步发展起来,已经出现如药明康德、康龙化成、泰格医药等从药物发现、临床前研究、临床研究等各个细分领域进入医药合同服务外包行业,并抓住行业快速发展机遇,通过不断向产业链两端延伸,发展成为中国医药合同服务外包行业中的领先企业。整体上看,中国传统医药合同服务外包行业发展时间短,行业内呈现小、乱、杂的局面,排名前十的医药外包企业市场占有率不超过50%,行业集中度较低。但伴随行业监管政策趋严,医药合同服务外包行业将进入调整期,不具备创新优势的中小企业将面临兼并淘汰,行业集中度有望提升。
3、MAH制度使得新兴起的生物科技企业与医药研发投资企业成为推动药品研发市场增长的重要力量:从政策上看,MAH制度自全面实施以来,持续释放政策红利。2020修订版《药品生产监督管理办法》对研究机构药品生产许可证明确了申请条件和要求,并在全国多地给多家药品研究机构持有人发布附带有委托生产的药品上市许可持有人的分类码的药品生产许可证,从法律上确定研究机构持有人的法律地位。
医药行业分工明确,MAH制度下,新兴起的生物科技企业与医药研发投资企业逐渐成为药品研发的主力。药品研发由于高风险高收益,MAH制度出台后,催生了众多新兴医药研发投资者,下积极参与药品研发投资,分享药品持证制度红利。根据IQVIA统计,新兴企业管线占比从2003年的52%逐渐增长至2018年的72%,而大型企业则由36%缩减至20%。新兴企业的活跃度逐渐成为全球医药行业的风向标。
初创企业对CRO行业依赖度较高。通常医药研发投资企业创办人员具有多年医药销售、研发的从业背景,对各药品的市场规模、竞争格局与技术壁垒等有深刻的了解,能够精准挑选合适的品种并投入研发,以期获得药品持证制度带来的市场红利;在这一过程中,各地政府通过参与设立医药产业基金的形式以支持医药研发投资企业的发展,并促进医药行业的转型升级。另外,新成立的医药研发投资企业由于团队人员精简,更追求效率和研发质量,通常会选择合同研发外包的方式,将药品研发外包给专业的研发机构,从而加速CRO行业的发展。
4、我国仿制药市场的发展将带动研发服务行业的发展:仿制药,是与原研药具有相同活动成分、剂量、给药途径、剂型及适应症的药物。因为我国的医药研发技术相对落后,现代医药学发展时间较晚,新药的研发难度和资金门槛不断提高,叠加大批原研药专利到期,多种因素导致我国成为仿制药大国。截至2019年,我国仿制药批件数的比例占所有化学药批件数的95%左右。从市场规模来看,2019年我国仿制药约占化学药市场的66%,占全部药品市场近半壁江山。根据中国医药工业信息中心测算,2019年化学制剂仿制药市场规模约为8,425亿元,受我国人口老龄化加速到来和疾病谱转变等因素,人民对仿制药的需求会进一步增加,未来我国仿制药市场将维持持续增长。
虽然我国仿制药整体市场规模巨大,是仿制药大国,但还不是仿制药的强国,我国仿制药的质量还需进一步提升。随着医疗改革的不断深入,国家对医药管理体制、运行机制和医疗保障体制提出了新的改革措施,推出了诸如“一致性评价”、“两票制”、“带量采购”、“药品上市许可持有人制度”等对医药行业影响深远的具体举措,促进医药行业健康发展,推动企业更加注重研发投入及仿制药质量的提升。仿制药“一致性评价”政策的不断推进,有利于提升我国仿制药的整体质量,从而在临床上实现仿制药与原研药的相互替代,提升仿制药的市场渗透率,而这又对仿制药企业的研发实力、技术水平以及上游原料药的质量等都提出了更高的要求。“两票制”的实施有利于规范药品流通秩序、压缩流通环节,提高流通效率,从而促进医药产业健康发展。“带量采购”政策的执行,将使相关药品的价格明显下降,成本将成为仿制药的重要竞争因素,同时也有利于降低流通环节成本,促进制药企业更加专注于研发。药品上市许可持有人制度将进一步推动药品研发生产和销售的分离,从而促进专业分工,为医药研发服务市场带来了新的发展机遇。新政策的实施进一步促进中国仿制药产业升级和结构调整。同时,一致性评价进入攻坚和验收的关键阶段,仿制药企业乃至整个医药产业正在经历阵痛,行业整合加速随之而来,集中度将进一步提升,优势资源向研发创新能力强,运营水平高的企业集聚,呈现强者恒强的态势。
因此,仿制药企业想要保持持续的竞争力,需要不断加大自身研发投入,通过委托外部专业研发服务企业、与外部专业研发企业联合研发或者直接购买外部研发企业技术成果等方式,提高研发的质量及效率,这将带动研发服务行业的进一步发展。

 400-1050-986
400-1050-986

