 市场资讯
市场资讯新闻资讯 更多+
1、生物制品质控试剂盒分类:生物制品质控试剂盒用于生物制品研发及生产过程中,针对原材料、过程样品及终产品,对可能影响生物制品质量及安全的相关参数,根据各国药监部门与生物制品生产厂商对生物制品的质量、规格、检验方法与限度、标准品等方面的规定,进行标准化的定性或定量检测,从而实现生物制品的质量控制。
生物制品质控试剂盒主要包括宿主残留细胞 DNA(HCD)检测试剂盒、宿主细胞残留蛋白(HCP)检测试剂盒、宿主细胞残留 RNA(HCR)检测试剂盒、外源风险因子检测试剂盒。再者,部分生物制品在生产过程中还会使用牛血清白蛋白(BSA)、Protein A、甘油、抗生素、胰酶和核酸酶等添加物,因此厂商还应根据具体工艺流程进行工艺残留添加物的检测,如使用 BSA 残留检测ELISA 试剂盒、Protein A ELISA 检测试剂盒、甘油三酯(TG)测定试剂盒、抗生素残留检测试剂盒、胰蛋白酶残留检测试剂盒和核酸酶残留检测试剂盒等。
此外,生物制品生物检测还包括细胞种属鉴别、基因与载体安全性的检测,相关检测试剂盒包括细胞 DNA 条码、基因拷贝数检测、RCR/RCL/RCAAV 检测和端粒酶活性检测等。这些检测试剂盒的应用范围包括抗体/重组药物、疫苗、细胞与基因治疗产品等生物制品,以及生物源医疗器械、生物工程类化学药的质量控制流程。
2、生物制品质控检测试剂盒市场发展变化趋势:随着国家对各类生物制品质控相关的法规逐渐完善,厂商对于生物制品质控方面的需求也将进一步提升,可实现快速高效检测的检测试剂盒的应用将持续增长。此外,随着基因治疗等新兴生物制品的临床优势逐渐得到验证,新兴生物制品生产厂商对于相关产品的质控需求也将逐渐增大,预计 HCD 检测试剂盒在整体试剂盒市场中的占比也将逐渐超过 HCP 检测试剂盒。
中金企信国际咨询公布的《全球及中国生物制品质控试剂盒市场监测调查及投资战略评估预测报告(2024版)》
3、生物制品宿主细胞残留 DNA(HCD)检测试剂盒分析:
(1)生物制品宿主细胞残留 DNA(HCD)检测试剂盒介绍与应用场景分析:宿主细胞残留 DNA(Host Cell DNA,HCD)检测试剂盒是用于定量检测生物制品中宿主细胞残留 DNA 的检测试剂盒。利用检测试剂盒可以同时处理多个样品,简化的工作流程还能最大限度地减少操作时间,且配备的相关仪器和分析软件能够简化数据分析流程,这在一定程度上帮助企业进行降本增效。
目前,HCD 检测试剂盒主要是采用 PCR-荧光探针原理,以实现对宿主细胞残留 DNA 的高灵敏度和高准确性的定量分析。宿主细胞残留 DNA 试剂盒检测流程包括 DNA 提取纯化和检测两个部分,生物制品的残留 DNA 含量一般处于 pg 或更低级别,且产品提取和纯化过程的变化会影响样品基质,因此检测的成功在很大程度上取决于对于初始样本的前处理。目前常用的样品 DNA 提取技术包括有机溶剂提取法、层析柱法、热裂解法及磁珠法等,赛默飞、湖州申科等厂商的 HCD 检测试剂盒均是采用磁珠法进行 DNA 提取,通过优化磁珠纯化DNA 技术,不仅可以克服高浓度蛋白质对检测结果的影响,而且磁珠的特性异吸附也能够显著提高 DNA 的提取效率。DNA 提取及纯化完成后,再通过在PCR 扩增过程中加入特异性的荧光探针定量检测分析样品中的 HCD。
中金企信国际咨询公布的《全球及中国DNA检测试剂盒市场发展战略分析及投资前景可行性评估预测报告(2024版)》
(2)生物制品宿主细胞残留 DNA(HCD)检测试剂盒:目前,HCD 检测试剂盒的主要竞争者包括赛默飞、Cygnus、湖州申科生物技术股份有限公司等,国产厂商在试剂盒的检测灵敏度等方面不断进行创新升级,逐步提高市场竞争力。
HCD 检测试剂盒竞争格局分析
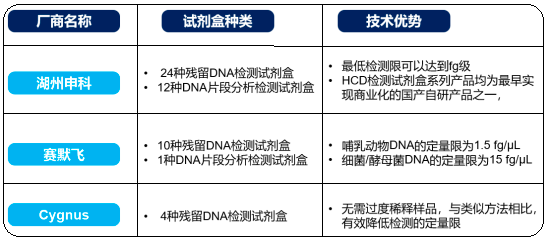
(3)生物制品片段化 HCD 检测试剂盒:残留 DNA 片段越大,潜在风险等级越高。因此,定量检测宿主细胞残留DNA 片段对监测生物制品的安全性和质量可控性具有重要意义。与国际通用的毛细管电泳法相比,通过定量 PCR 法制成的多种宿主细胞残留 DNA 片段分析检测试剂盒,具有灵敏度高、准确性高、重复性好、操作简便、样品通量较高、能进行种属鉴定等优势,片段化 HCD 检测试剂盒覆盖的片段越长、检测灵敏度越高,就越能适用于生物制品工艺中各种样本的质量控制。
虽然片段化 HCD 检测试剂盒具有众多优势,但其产品开发难度较大。在大部分 qPCR 体系中,扩增片段长度限定在 50-150bp,扩增片段过长,会给实验体系的稳定和灵敏度带来较大影响。原因在于,长片段扩增时经常会产生较短的非特异扩增,由于 qPCR 中信号的主要来源是长度较小的荧光探针,一旦出现非特异性扩增,非常容易引起荧光信号的异常;同时目标片段的长度越长,越容易产生复杂的空间结构,容易影响扩增体系,因此对厂商在引物探针设计、体系优化等过程的技术要求较高。
(4)生物制品 HCD 检测必要性分析:抗体、重组蛋白等生物制品是由连续传代细胞系,如 CHO(Chinese Hamster Ovary Cell,中国仓鼠卵巢的上皮细胞系)细胞、NS0(Non secreting Murine Myeloma,非分泌型小鼠骨髓瘤细胞系)细胞等进行表达生产的产物,由于这些连续传代的细胞其调控生长的基因失调,使其具有无限增殖的能力。因此,传代细胞系的 DNA 会使细胞生长失控,并可能产生潜在风险。此外,一些研究表明,HCD 片段也是重要的风险因素,若基因片段被转座子整合到染色体中的关键位置,可能会激活癌基因或抑制抑癌基因,一般认为,可能致病的功能基因至少在 200bp(Basepair,碱基对)以上,因此残留 DNA 片段越大,潜在风险等级越高。为确保宿主细胞残留 DNA 的去除效果,有必要建立准确度高灵敏度好的残留 DNA 检测方法,确保生物制品的安全性和质量。
监管部门对 HCD 的残留量有明确的规定。美国 FDA 发布的指导原则中指出生物制品 HCD 残余限度为 100pg/剂,对于大剂量生物制品如单克隆抗体,根据其残留 DNA 来源及给药途径,残留量可放宽至 10ng/剂。《欧洲药典通则》规定生物制品 HCD 限度大多为不超过 10ng/剂,但对个别疫苗的残留 DNA 限定标准更严格,如甲型肝炎灭活疫苗中的 DNA 残留量不得超过 100pg/剂,乙型肝炎疫苗中的 DNA 残留量不得超过 10pg/剂。《中国药典 2020 年版三部》规定,以细胞基质生产的生物制剂 DNA 残留量不能超过 100pg/剂,以细菌或真菌基质生产的疫苗 DNA 残留量不能超过 10ng/剂。
此外,中美等国家对残留的 HCD 片段也有着明确的限量要求,如 FDA 在《关于人类基因治疗新产品生产指导文件》中明确指出 HCD 的片段要小于200bp;NMPA 生物制品药学部同样在《基因治疗产品药学研究与评价技术指导原则》的征求意见稿中指出,HCD 的片段要小于 200bp。
免责声明:
本站新闻、行业资讯、新闻资讯、市场资讯等公开信息中部分内容与图片来自网络、媒体或网友(含三方合作机构)提供,版权归原作者。中金企信本着尊重与保护知识产权的原则,若出现本站公开内容存在文章内容或图片内容版权与其他问题请联系我司。联系方式:010-63853556,zqxgj2011@163.com,我司将第一时间回应并处理。

 400-1050-986
400-1050-986

